 会员动态
会员动态
 生物制药小编
生物制药小编  2018-06-27
2018-06-27
 16451
16451
自3月13日南京传奇宣布获得国内首个CAR-T临床批件以来,下一张CAR-T临床批件花落谁家就成了业界翘首以盼的新闻,尤其是争夺激烈的CD19靶点(南京传奇的靶点是BCMA)。刚刚,上海药明巨诺生物科技有限公司及其关联公司上海明聚生物科技有限公司宣布,国家药品监督管理局(CNDA)批准明聚生物CAR-T产品JWCAR029的IND申请,成为首张CD19靶点的临床批件。
截至发稿时,CDE共受理23个CAR-T细胞产品的IND申请,其中CD19为19个,占到83%。这19个申请来自14家公司,其中优卡迪和恒润达生各申报3个,西比曼申报2个。
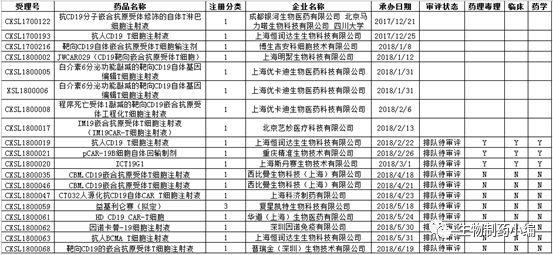
从审评进度来看,8个受理在CDE的在审目录里查不到,意味着CDE已经对申报资料至少做过一轮评审。结局无非两点,等待临床批件,或者补资料。另外,恒润达生的第2个申请、重庆精准生物和斯丹赛的申请也完成药学、药理毒理和临床的三项审评,尽管状态仍未排队待审评。另8个申请还出于排队状态。也就是说,在19个CD19 CAR-T申报中,CDE已经看过11个的申报资料,比例为58%,超过一半。
关注CDE细胞药物受理及审评进度的朋友可能会注意到这样一个规律,CDE秉持先申报、先受理、先审评的原则。对照笔者前段时间总结的“国内细胞治疗产品受理情况浅析”,这1个月来的审评进度变化为:科济的首个申报和恒润达生的第2个申报完成临床部分审评,并且科济的申报从在审目录中消失;重庆精准生物和斯丹赛的申报完成审评,从受理日期算起,大约为四个月,不算排队时间,CDE的审评时间约在1个月左右。
回到药明巨诺关联公司明聚生物的申报,该IND申请的受理号为CXSL1800002,为18年首个获得受理的细胞治疗产品,具体日期为1月12日,其申请则早在17年底。从受理到获得批件,为时5个半月;如果从递交申请算起,则为半年左右。其他打算申报细胞药物IND的公司可以据此估算本公司产品大致的审评进度。
尽管明聚生物不是首个递交CD19CAR-T申报的公司,却最早获得临床批件,可见除了速度,质量更关键。依托和巨诺的合作,药明巨诺在CAR-T药物研发上处于领先地位。国内另一家类似模式的公司为复星凯特,其CD19 CAR-T申报已获得受理,受理号为CXSL1800059,受理日期为5月18日,尚未开始审评。
有意思的是,在国际CAR-T药物研发第一梯队中,诺华和凯特的产品已经于去年获得FDA批准上市,其中诺华产品的第二个适应症也于今年获得FDA批准。巨诺由于首个产品临床上先后出现受试者死亡,被迫改变产品设计策略,可谓起了个大早,赶了个晚集。根据研发进度来看,预计巨诺的产品将于今年下半年或明年在美国上市;而巨诺合作企业摘得国内首个CD19临床批件,也算弯道超车,报了一箭之仇。
可以预见的是,伴随明聚生物的临床批件获批,接下来一段时间将会有其他申报陆续获得临床批件。国内CAR-T药物开发的竞争将进入下一阶段,即临床疗效和安全性的比拼。谁将首先获批上市,靠的还是研发实力;前期为了赶进度递交申报资料的公司,将在审评及后续环节付出惨痛代价。
 会员动态
会员动态
 新康界
新康界  2025-05-02
2025-05-02
 139
139

 会员动态
会员动态
 信达生物
信达生物  2025-04-29
2025-04-29
 210
210

 会员动态
会员动态
 医药笔记
医药笔记  2025-04-26
2025-04-26
 170
170