 研发追踪
研发追踪
 药明康德
药明康德  2023-04-10
2023-04-10
 3226
3226
今日,Vertex和CRISPR Therapeutics公司宣布已经完成向FDA提交其共同开发CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)的滚动生物制品许可申请(BLA),用于治疗镰刀状细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)患者。此疗法在欧盟与英国的监管申请已于2022年完成,欧洲药品管理局(EMA)与英国药品和医疗产品监管署(MHRA)已在今年1月开始进行审评。
Exa-cel是一款自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。通过exa-cel治疗,可以提高HbF水平,有可能缓解TDT患者的输血需求,并减少SCD患者的疼痛和使人衰弱的血管闭塞性危象(VOC)。Exa-cel获美国FDA授予SCD和TDT的再生医学先进疗法(RMAT)、快速通道、孤儿药和罕见儿科疾病认定。
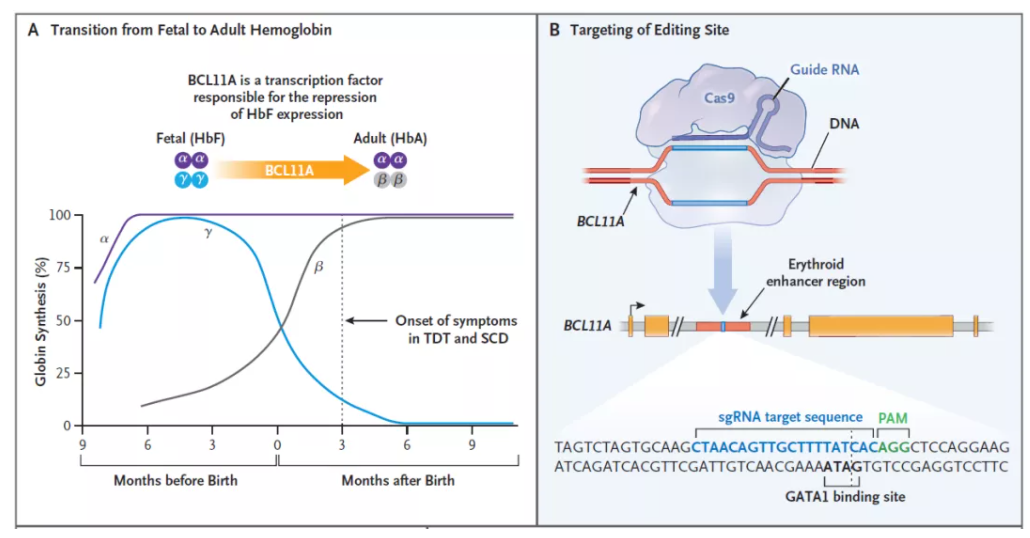
▲Exa-cel的作用机制:A,BCL11A是下调胎儿血红蛋白表达的转录因子;B,exa-cel通过对BCL11A进行基因编辑,上调胎儿血红蛋白的表达(图片来源:参考资料[2])
这些监管申请获得正在进行的3期试验CLIMB-111和CLIMB-121,以及正在进行的长期随访CLIMB-131试验结果支持。此前公布的临床试验结果显示exa-cel具有一次治疗,提供功能性治愈的潜力。在接受治疗的44名TDT患者中,42名在随访时间为1.2~37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。所有31名接受治疗的严重SCD患者在随访时间为2.0~32.3个月时,均未出现血管闭塞性危象。
“我们exa-cel全球监管申请的完成是一项历史性的里程碑,”Vertex全球药物开发和医疗事务执行副总裁兼首席医学官Carmen Bozic博士说道,“我们要感谢临床试验受试者和镰状细胞和β地中海贫血患者群体,以及支持他们的医生、护士、协调员、护理人员和朋友。”

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 82
82

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 83
83
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 85
85