 研发追踪
研发追踪
 Insight数据库
Insight数据库  2023-04-10
2023-04-10
 2968
2968
4 月 3 日,阿斯利康宣布,长效 C5 补体抑制剂 Ultomiris 治疗抗水通道蛋白 4(AQP4)抗体阳性(Ab+)视神经脊髓炎(NMOSD)的新适应症上市申请获 CHMP 推荐批准,离欧洲上市又近了一步。
截图来自:阿斯利康官网,下文如无提及均同
去年 5 月,Ultomiris 的 III 期临床 CHAMPION-NMOSD 研究达到主要终点,使之成为首个也是当前唯一一个在中位治疗 73 周的患者中观察到零复发的长效 C5 补体抑制剂。同年 10 月,阿斯利康在第 38 届欧洲多发性硬化治疗与研究委员会大会(ECTRIMS 2022)上公布了其详细数据,并表示已在欧美日三个主要市场提交了新适应症上市申请。
Ultomiris 是阿斯利康斥 390 亿美元巨资收购 Alexion 公司获得的关键产品之一,也是重磅炸弹 Soliris(依库珠单抗)的接棒产品。依库珠单抗在 2007 年获批,销售的常年未有下滑,显然证实了补体抑制剂患者需求之稳定:以 2019 和 2020 年为例,其年销售额分别达到 39.46 亿美元、40.64 亿美元。
近 6 年药品销售额数据
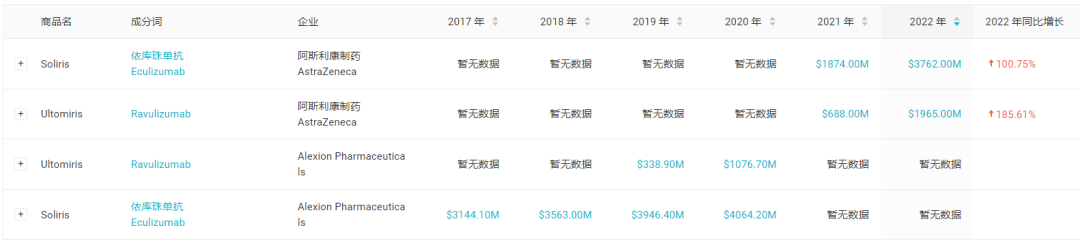
截图来自:Insight 数据库网页版(http://db.dxy.v5/home/)
*由于 AZ 收购原因,2021 年度销售额自 7 月起计,低于实际药品销售额
CHAMPION-NMOSD 是一项开放标签、全球多中心 III 期临床,评估 Ultomiris 在成年 NMOSD 患者中的有效性和安全性。该试验在北美、欧洲、亚太地区和日本招募 58 名患者,出于伦理原因,未设置直接安慰剂对照组,将结果与 Soliris 关键临床 PREVENT 研究的外部安慰剂组作对比。
结果显示,中位治疗 73 周,Ultomiris 治疗的患者中观察到零判定复发(复发风险降低:98.6%,HR (95% CI) = 0.014 (0.000,0.103),p<0.0001)。此外,接受 Ultomiris 治疗的患者在 48 周时 100% 无复发,而外部安慰剂组患者为 63%。
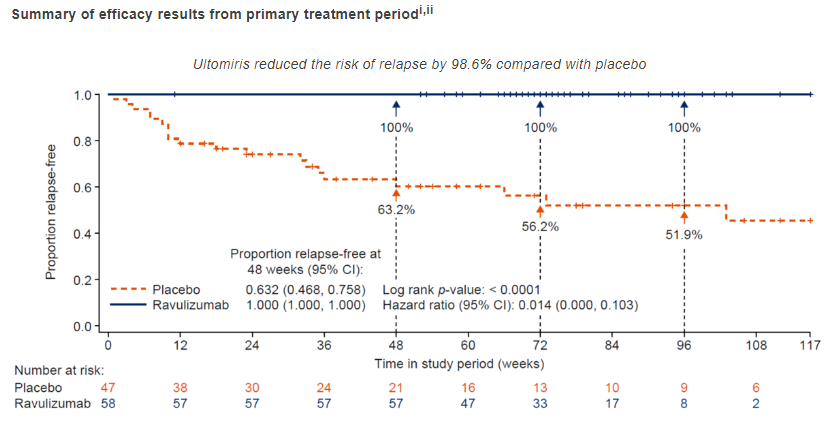
CHAMPION-NMOSD 试验也达到了关键的次要疗效终点,包括试验期间年化复发率(研究中的复发总次数除以总患者年数)和根据 Hauser 步行指数(评估移动能力的量表)测量的移动能力(行走能力)相对基线的临床重要变化。

安全性方面,Ultomiris 与以往临床试验和真实世界结果一致,未观察到新的安全性信号。
此前在年报中,阿斯利康预计,将在今年上半年取得 Ultomiris 治疗 NMOSD 的监管批准;下半年,Soliris 有两项适应症预计在中国有望获批;明年,Ultomiris 还有两项适应症将有关键临床数据读出。

截图来自:阿斯利康年报
据 Insight 数据库显示,Ultomiris 最早在 2018 年度首先在美国获批,当前已经批准 3 大适应症:阵发性睡眠性血红蛋白尿症(PNH)、非典型溶血尿毒综合征(aHUS)和重症肌无力,22 年销售额已攀升至 19.65 亿美元,同比增长 42%。
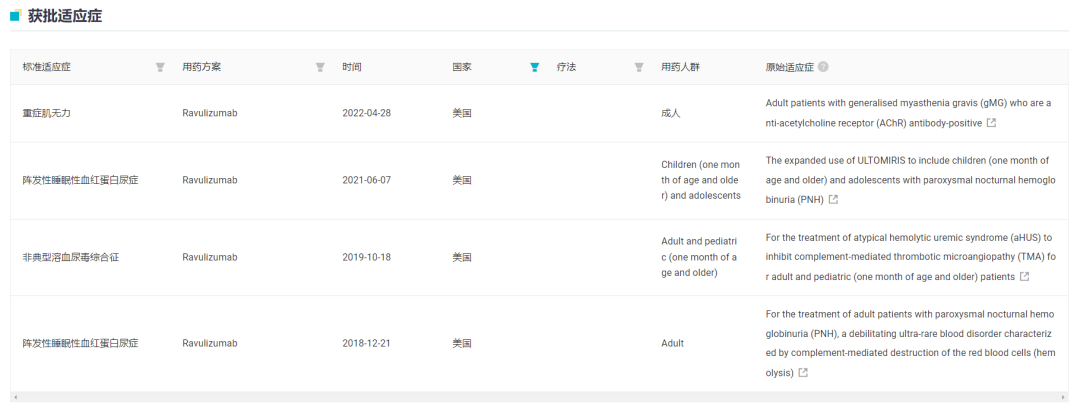
截图来自:Insight 数据库网页版
英文链接:https://www.nasdaq.com/articles/astrazeneca-azn-ultomiris-gets-chmp-nod-for-new-rare-disease

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 81
81

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 83
83
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 85
85