 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2023-10-19
2023-10-19
 3393
3393
近年来,在“创新驱动”国家战略引领下,中国在研药物数量和上市新药数量均已稳居全球第二梯队之首,成为全球医药创新高地之一。同时,随着ICH指导原则在我国转化实施,中国药品审评审批制度正在逐步与国际接轨。这不仅使中国企业能够参与全球药物同步研发和同步注册,也为国产创新药走向国际市场创造了关键条件。
实际上,不少本土创新药企业已纷纷通过对外授权、在当地自建运营能力、联合当地科研机构进行早期研发等多种方式开始走出国门。在广阔的海外市场中,美、欧、日基于其成熟的药品监管体系、友好的市场支付环境以及众多欠发达国家对其监管结果的高度认可,已成为不少企业出海的首选目的地。除发达国家市场外,广阔的发展中新兴市场国家也正在成为本土企业出海的另一重要选择。
在这个过程,企业面临着诸多困难,其中产品注册审评标准差异等多方因素造成的监管准入壁垒是当前中国创新药出海面临的较为突出的挑战之一。据2019年WHO调研报告显示,超过50%的成员国技术审评能力不足以独立完成符合药品监管的基本要求,依靠其他值得信赖的监管机构的工作是其满足本国不断增长的健康服务需求的唯一途径。
笔者对目前全球监管协同活动和趋势研究发现,FDA采取了多方行动提高其在全球范围内的认可程度;WHO则通过制定互信、互赖原则指南、发布国家监管机构能力评估工具等方式推动全球范围监管协同。
本篇文章将首先与读者分享FDA的国际化进展及启示,后续有关WHO经验分享以及对当前企业出海破局路径的思考将陆续发出。
全球典型药品监管协同与合作方式
从全球主要的药品监管协同与合作方式总体上看,药品监管协同已经成为全球主要国家和主要区域经济体的惯常做法。然而,如下图1所示,实现监管信赖并非一蹴而就,而是一个长远、不断积累信任与信心的过程。实践中,由于监管机构间、区域间建立的信任水平不同,多层次的监管协同和合作模式可分为4个层次,如下表1所示,从信赖程度由低到高分别为信息共享、通用标准建立、工作共享、监管信赖与认可。

图1 推动药品监管国际协同路径 来源:WHO
表1 全球典型药品监管协同与合作方式梳理
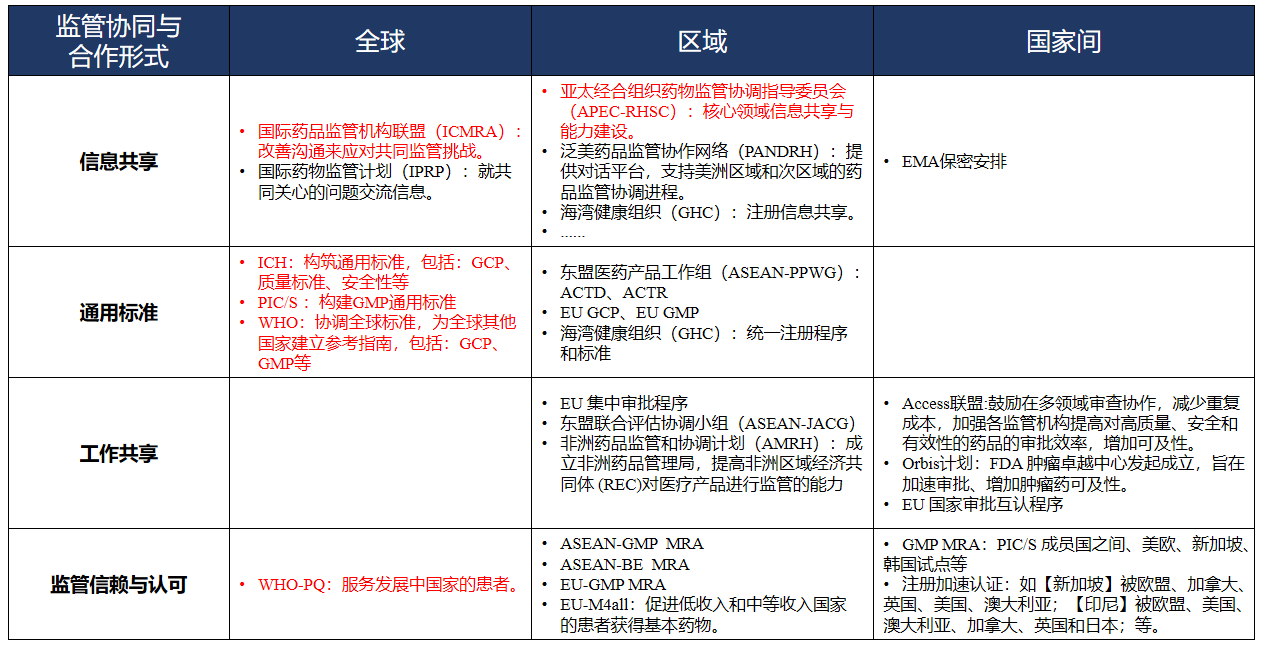
参考:艾社康《推动区域药品监管合作,提升创新药在亚太地区患者的可及性》、中国药促会整理
如上表1所示,标红部分是中国药监局已经参与和正在推动的部分全球性的监管协同或区域协同的程序,中国在落实转化全球标准,加速药品监管国际化接轨方面取得了非凡的成效。通用标准的建立和落实则是推动药品监管全球化的基础,以ICH和PIC/S为全球监管标准代表,中国积极加入国际标准互认和协作,基本实现了从全球规则的执行者向制定者的角色转变。截止目前,中国ICH指导原则转化率达到了100%,推动了药品全生命周期管理流程进一步与国际接轨。同时,中国积极推动加入PIC/S,目前已经完成预申请阶段工作,计划今年提出正式加入申请,以促进建立对标国际的药品质量管理水平和能力。
中国已经在为充分融入全球药品监管体系做准备,但未来仍要继续深化全球合作形式与内容,推动中国药品监管结果尽早被海外监管机构认可,助力本土企业出海。
FDA获得了全球监管机构的广泛认可
1.FDA全球化活动梳理
在推动药品监管国际化方面,FDA成就显著,获得了全球监管机构的广泛认可。下图2所示,是FDA与全球多个区域监管互信概览,可以看到无论是在欠发达区域/国家,还是在欧洲、日本、澳大利亚等药品监管能力较为成熟的区域/国家,FDA的监管决策结果都具有较高的公信力。具体而言,在欠发达区域,认可往往是单向的,即欠发达地区监管机构单方认可FDA的监管决策;而在监管能力较强的区域,FDA往往通过工作共享、互信,来避免监管资源浪费,从而实现双方互信互赖。
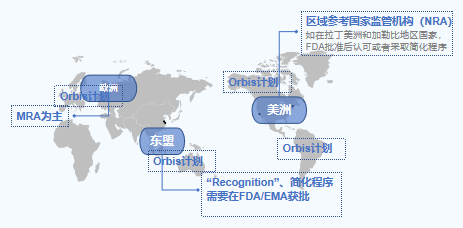
图 2 FDA获得诸多国家/地区认可 来源:中国药促会整理
下图3是笔者梳理的FDA药品监管协同部门和协同项目,可以看出在FDA内部不同部门之间形成了高效的分工与协作,致力于推进FDA监管决策结果在全球范围内的认可。可概括为四个方面:
一是,提高透明性。加强整个药物生命周期监管活动的透明度是良好的合作与协调的基础,其意义不仅仅是对本国公众、产业和政府负责,也在于提升其他国家监管机构对FDA决策的信心,为进一步的信赖奠定基础。FDA系统性地提高监管决策的透明度,最早可以追溯到1992年PDUFA的颁布,法案合理的制度设计促成了FDA与制药行业形成相互约束、共同发展的良好态势,加深了各方对FDA监管行动的可获得性,为FDA赢得了多方利益相关者的信赖与认可。
二是,更多的交流与互动。在对外交流互动方面,FDA向来是主动的,进取的。一方面,FDA向全产业,包括国内外企业、海外监管机构等提供培训教育和交流的机构,增强FDA对外输出以获得认可;另一方面,开展演讲和对各方传播,进一步加深各方对FDA的了解,包括FDA驻外办事处在全球高度活跃地收集、分析以及传播相关消息(包括检查数据);此外,FDA致力于与全球几个领先的监管机构进行工作和信息共享,在实际药品审查活动中,提升FDA的公信力。
三是,增强海外监管力度和能力。监管事务办公室(Office of Regulatory Affairs,ORA)的跨国检查、召回、药物警戒是FDA推动国际监管互信的重要保障。在涉及风险较高的产品,必要时,FDA可派遣相关执法人员开展现场检查。
四是,充分利用国家/区域监管协调组织。在利用区域协调组织方面,除国际社会高度关注的ICH、PIC/S外,FDA还专注于支持如:国际药品监管机构联盟(International Coalition of Medicines Regulatory Authorities,ICMRA)等国际组织的全球对话平台,同时高度关注区域尤其是在泛美卫生组织(Pan American HealthOrganization,PAHO)下的区域监管协同监管体系。
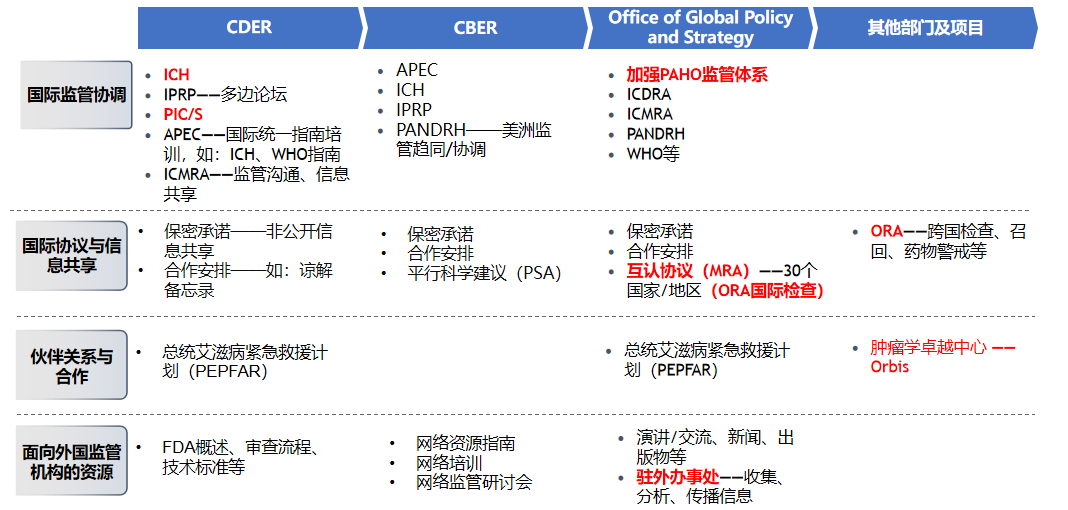
图 3 FDA 全球监管协同策略梳理 来源:中国药促会整理
2. FDA高度关注其所在区域国际合作与交流
FDA高度关注与美洲地区的国际合作,包括:加强药品监管体系协同和提高药品可及。自2010年起,全球政策与战略办公室(Office of Global Policy and Strategy,OGPS)即通过向与PAHO提供资金支持和技术合作来加强拉丁美洲和加勒比地区的监管体系,一方面协调美洲区域内标准和准则,使其更加兼容,另一方面,使得这些国家更加了解FDA等药品监管机构的运作方式。
区域监管机构能力评估工具是FDA和PAHO之间合作的重要成果之一。通过评估各国的优势,以及他们如何通过采用标准化方法改进美洲医疗产品的监管系统,在此基础上,PAHO认可了八个区域参考机构,分别是阿根廷、巴西、加拿大、智利、哥伦比亚、古巴、墨西哥、美国,共同覆盖了美洲82%的人口。如下图4所示,横轴代表该区域国家,纵轴代表被参考的监管机构,可以看出美洲区域内药品监管协同成就显著,给予了阿根廷、巴西、智利等国家更多的发展机遇。
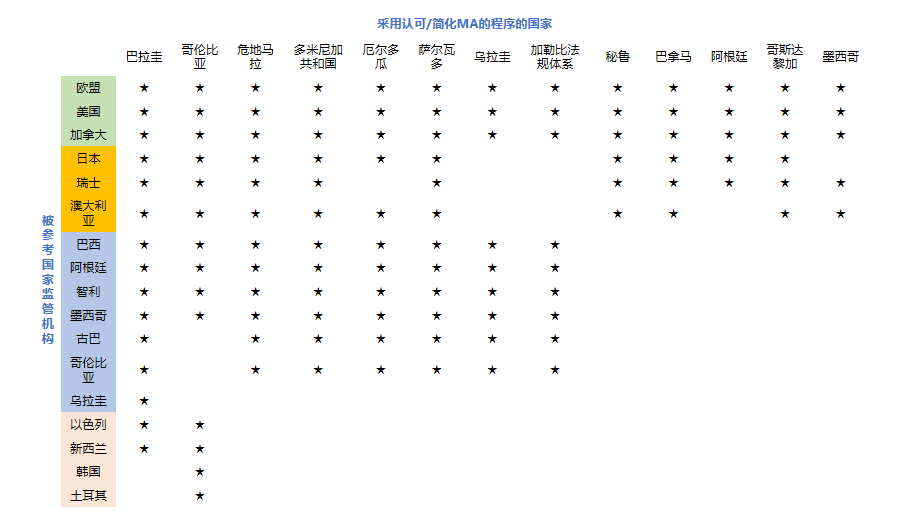
图 4 拉丁美洲和加勒比国家的认可药品监管机构 来源:Carlos E. Durán等《Regulatory reliance to approve new medicinal products in Latin American and Caribbean countries》
FDA推动药品监管协同经验启示
1. FDA高度分工、高效率的全球化组织机构设置和分工
高度分工是FDA全球化监管协同的一大重要特征。除广为熟知的CDER、CBER、ORA在其全球化监管协同中发挥科学支撑外,较少被关注到的——FDA OGPS则发挥了重要的战略引领和政策执行作用。截止目前,OGPS在全球拥有5个驻外办事处(Office of Global Operations),另有OGPS办公室(OGPS OFFICE)辐射范围覆盖全球229个国家/地区,形成了错综复杂的全球网络。
OGPS的职责包括促进与FDA在全球公共卫生和监管利益政策行动;改善海外监管机构对FDA要求的遵守情况,提高检查和实验室分析能力,发展全球伙伴关系;在全球范围内收集、分析和共享高质量信息(包括检查数据),推进FDA的公共卫生使命。
由此可见,中国推动创新药出海,企业做好产业布局只是其中一个方面,也应当发挥政府机构的力量,寻找对外工作抓手,明确分工与协作,从国家层面推动中国与其他国家药品监管机构互信互赖。
2. FDA规则制定者优势
美国是ICH发起国之一,也于2011年正式加入了PIC/S,通过参与国际规则的制定和转化,使得FDA监管规则更加深入地融入全球监管体系,帮助美国生物医药企业能够更高效地进行全球化布局,给予更多的全球机会。同时,FDA也致力于不断巩固其全球规则制定者身份,如:根据PDUFA Ⅶ承诺,FDA将在未来5年通过用户费用支持其利用ICH、ICMRA等组织的力量以促进融合,来保证美国技术和创新举措产生的数据的通用性和可解释性。
中国在ICH落地方面已取得非凡成效,未来,中国一方面需要继续推动已有ICH、PIC/S等国际规则的实施应用;另一方面,也应当挖掘优势领域,加强监管科学研究,继续巩固规则制定者身份。
3. 加强不同形式的交流沟通形式
在全球化程度日益增加的世界中,信息共享和传播在监管决策中的重要性日益增长。FDA在不断与各国交流中,让他国监管机构了解FDA、认识FDA,从而推动FDA在世界范围内广泛的认可。
药品监管审评审批制度改革以来,中国药品监管规范化和国际化向前迈进了一大步。中国应当抓住加入PIC/S机遇,通过举办官方交流活动和推进其他各种交流互动方式,加强海外监管机构对中国药品监管能力和中国企业的了解。
4. 持续加强监管资源配备和监管能力提升
FDA的成功经验,一方面可归结于FDA始终积极地推进国际活动,更重要的是在其一百多年的药品监管史中,不断加强资源配备,关注监管能力建设、提高监管透明度,建立起了一支高水平的、具有一定规模的监管队伍,这是其成为全球最具权威的监管机构并获得广泛认可的坚实基础。因此,中国也应当持续加强监管资源配备和监管能力提升,为建立互信互赖奠定良好的基础。
众所周知,各国政策都有其根植的土壤,在借鉴国际经验时,应当充分、全面地了解、分析,并结合本国国情和所处的国际环境,探索出适应国家或区域特色的解决方案,这一原则同样适用于推进中国药品国际监管互信。
中国医药创新促进会 政策研究中心
作者:张帆 助理分析师 zhangf@phirda.com
审核校对:张志娟
声明:本文内容仅提供信息性参考,不构成具体市场投资建议,也不可直接作为决策内容,中国医药创新促进会不对任何主体因使用文中内容所导致的任何损失承担责任。
课题交流欢迎联系作者
为推动我国国产创新药开拓国际市场,积极把握RCEP生效实施带来的贸易便利化机遇,中国医药创新促进会政策研究中心设立了“中国创新药出海技术路径研究”专题,首先聚焦在一体化程度相对较高、经济发展水平具有相当潜力的“东盟”国家,以通过研究和推进药监注册路径与标准共识,推动与东盟国家建立双边/多边互信。
●预期目标:
一是进行战略层面的研究,论证和推进国产创新药出海与国家相关部门战略的融合与链接,推动出台有利于创新药出海的政策;
二是重点研究和推进药监注册技术路径和标准共识;
三是基于以上,探索建立与重点国家从多边或双边的沟通或合作机制。
欢迎对该课题内容感兴趣的专家和产业同仁提出宝贵意见和建议,请联系课题负责人:张志娟 15810110185(同微信)。

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2024-11-13
2024-11-13
 10
10

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2024-11-13
2024-11-13
 13
13

 产业资讯
产业资讯
 凯莱英药闻
凯莱英药闻  2024-11-13
2024-11-13
 13
13