 产业资讯
产业资讯
 药事纵横
药事纵横  2026-01-31
2026-01-31
 16
16
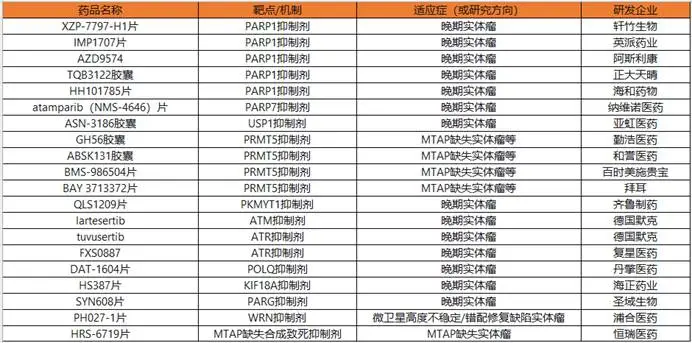
2025年,合成致死疗法在中国驶入了研发快车道。随着超20款基于该机制的1类新药首次获批临床,靶点布局已从PARP扩展至USP1、PRMT5、WRN等十余个新兴方向。这不仅是靶点上的“百花齐放”,更意味着该策略正从理论走向多样本、多赛道的临床验证阶段。
2025年中国获批临床的20款“合成致死”机制1类新药
PARP之后,谁是下一站?
合成致死疗法是恶性肿瘤精准治疗的潜力方向,核心机制为利用肿瘤细胞特有基因缺陷,靶向抑制互补基因功能以诱导癌细胞选择性凋亡,同时降低对正常细胞的毒性,提供了全新治疗路径。
PARP抑制剂的临床成功验证了合成致死策略的可行性,成为该领域重要里程碑。自2014年奥拉帕利获FDA批准上市后,尼拉帕利等同类药物陆续落地,在卵巢癌、乳腺癌等多种肿瘤中展现显著获益与可控安全性,为BRCA1/2突变患者构建了全新治疗体系。
但PARP抑制剂存在明显局限,部分患者会出现原发或继发性耐药,且适应症仅局限于BRCA1/2等同源重组修复(HRR)通路缺陷人群,难以覆盖广泛肿瘤患者。这驱动行业加速探索新型合成致死靶点,拓展疗法应用边界。
在此背景下,USP1、PRMT5、ATR、WRN等机制明确、转化潜力显著的新型合成致死靶点逐步进入临床开发阶段,成为全球研发焦点。
泛素特异性蛋白酶1(USP1)是DNA损伤修复通路关键去泛素化酶,通过调控基因组完整性、抑制非同源末端连接(NHEJ)通路发挥作用。在BRCA1缺陷细胞中,USP1介导复制叉保护,其特异性抑制可导致复制叉失稳、DNA损伤累积及癌细胞凋亡。目前KSQ-4279等USP1抑制剂已进入Ⅰ/Ⅱ期临床,聚焦BRCA1/2突变肿瘤,为克服PARP抑制剂耐药提供新方向。
蛋白精氨酸甲基转移酶5(PRMT5)参与多重生理过程,其与甲硫腺苷磷酸化酶(MTAP)缺失肿瘤的合成致死效应已被证实。MTAP缺失导致甲硫代腺苷(MTA)蓄积并抑制PRMT5活性,选择性抑制PRMT5可对MTAP缺失肿瘤细胞诱导合成致死,且对正常细胞毒性较低。2025年,勤浩医药GH56胶囊、和誉医药ABSK131胶囊等PRMT5抑制剂首获NMPA临床批准,为MTAP缺失实体瘤精准治疗提供新路径。
共济失调毛细血管扩张和Rad3相关蛋白(ATR)是DNA损伤应答通路核心激酶,可启动ATR-CHK1信号级联反应,维持基因组稳定性。ATM/CHK2/p53通路缺陷癌细胞高度依赖ATR通路,特异性抑制ATR可破坏DNA修复机制并诱导癌细胞死亡。ceralasertib、elimusertib等ATR抑制剂正处于Ⅰ/Ⅱ期临床,单药有效且与放疗、免疫治疗协同增效,在提升肿瘤放射敏感性方面潜力显著。
沃纳解旋酶(WRN)属RecQ家族,参与DNA修复及端粒维持,其与微卫星不稳定性(MSI)/错配修复缺陷(dMMR)肿瘤的合成致死关系为研究热点。WRN功能缺失可导致MSI/dMMR肿瘤细胞DNA损伤累积,而正常细胞可通过其他通路代偿,使其成为特异性靶点。拜耳旗下VVD-214在早期临床中展现良好耐受性及初步活性,为MSI/dMMR实体瘤患者提供新选择。
新型合成致死靶点的临床转化潜力需结合机制特性、临床进展及竞争格局综合评估。从研发进度来看,ATR抑制剂的临床探索最为深入,其单药及联合治疗的安全性与有效性数据已在多项临床试验中得到初步验证,协同治疗优势显著;USP1抑制剂凭借针对PARP抑制剂耐药的差异化定位,具备明确的临床需求导向;PRMT5抑制剂聚焦MTAP缺失这一特定人群,精准填补细分领域治疗空白;WRN抑制剂则在MSI/dMMR肿瘤中展现出特异性治疗价值,各靶点均具备成为明星靶点的潜力。
从竞争格局而言,合成致死赛道的研发热度持续攀升,全球范围内多家药企与科研机构布局上述靶点,同质化竞争趋势逐步显现。在此背景下,具备独特技术平台、高效临床转化能力及深度机制研究储备的团队,更易在靶点开发与药物优化中形成差异化优势,加速临床转化进程。
布局合成致死赛道
在全球合成致死疗法的研发竞赛中,中国药企已从早期的靶点跟随、仿创结合模式,逐步向靶点差异化开发、源头创新转型,这一转变不仅体现了国内药企研发实力的显著提升,更反映了我国生物医药产业从政策驱动向创新驱动的生态升级,形成了大型药企与Biotech公司协同发展的产业格局。
恒瑞医药作为国内创新药领军企业,在合成致死领域构建多元化布局。其自主研发的氟唑帕利胶囊(国内首款获批乳腺癌适应症的PARP抑制剂),2024年12月拓展新适应症,获批单药或联合阿帕替尼用于gBRCAm HER2阴性乳腺癌治疗,FABULOUS研究证实该方案较标准化疗显著延长患者PFS与OS,安全性可控。此外,恒瑞布局PRMT5抑制剂HRS-6719片,依托MTAP缺失导致的MTA蓄积增强肿瘤细胞敏感性,构建合成致死策略,该药已获NMPA临床批准,有望填补MTAP缺失实体瘤治疗空白。
复星医药以“自主研发+合作创新”双轮驱动加速合成致死疗法转化。2022年与英矽智能合作,借助AI技术开展靶点发现与优化,2024年获第二款合成致死相关临床前候选化合物,此前合作的QPCTL靶向药物已进入Ⅰ期临床。其子公司布局的PLK1抑制剂XS-03片,与KRAS突变存在合成致死关联,在KRAS突变结直肠癌细胞模型中活性显著,目前其单药治疗RAS突变晚期实体瘤的Ⅰ期临床正在国内开展,临床前安全性与活性良好。
正大天晴依托其在抗肿瘤领域的研发积累,持续深耕PARP抑制剂赛道,其自主研发的PARP1特异性抑制剂TQB3122胶囊于2025年获NMPA临床试验批准。基于PARP1的合成致死机制,TQB3122胶囊有望在BRCA1/2及其他HRR通路缺陷肿瘤中展现治疗价值,进一步丰富国内PARP抑制剂的产品矩阵,为肿瘤患者提供更多治疗选择。
除大型药企外,轩竹生物、勤浩医药、亚虹医药等Biotech公司凭借聚焦性研发策略与前沿技术储备,在合成致死细分靶点领域实现突破,为赛道发展注入创新活力,形成“巨头引领、新锐突破”的产业生态。
轩竹生物以“大小分子双驱”战略布局合成致死领域,其高选择性、血脑屏障穿透性PARP1抑制剂XZP-7797-H1片,临床前在BRCA1突变乳腺癌及胰腺癌模型中均展现显著抗肿瘤活性。同时,公司布局同类首创USP1抑制剂XZP-6924(已获NMPA临床批准),依托USP1与BRCA1缺陷细胞的合成致死机制,为难治性BRCA1/2突变肿瘤提供新方向,抢占靶点研发先机。
勤浩医药聚焦肿瘤精准治疗,其PRMT5抑制剂GH56胶囊于2025年获NMPA临床批准,核心靶向MTAP缺失肿瘤的合成致死效应。该药通过选择性抑制PRMT5活性诱导肿瘤细胞凋亡,且对正常细胞毒性低,依托公司专业平台推进研发,有望在MTAP缺失肿瘤领域形成差异化优势。
亚虹医药深耕泌尿生殖系统肿瘤领域,其USP1抑制剂ASN-3186胶囊(2025年获NMPA临床批准),依托USP1与BRCA1缺陷细胞的合成致死机制诱导癌细胞凋亡,为BRCA1/2突变肿瘤提供新选择。公司结合自身临床积累,实现合成致死机制与特定肿瘤类型的精准结合。
目前,中国药企在合成致死赛道已形成多元化、创新化的发展格局,研发实力与临床转化能力持续提升。随着机制研究的深入与技术平台的迭代,国内药企有望在合成致死领域实现更多源头创新突破。
从精准到广谱
尽管合成致死疗法在靶点探索与药物研发领域取得显著进展,但从基础研究到临床转化仍面临多重瓶颈,生物标志物匮乏、患者筛选困难、耐药机制复杂及适应症局限等问题,制约了其向广谱抗癌疗法的升级,需通过多学科交叉融合寻求突破。
生物标志物体系不完善是核心瓶颈。精准标志物是筛选获益人群、预测疗效的关键,但多数合成致死靶点缺乏明确伴随诊断标志物。BRCA1/2突变作为PARP抑制剂的经典标志物,仍存在预测局限,单一标志物难以实现精准分层;USP1、PRMT5等新兴靶点的标志物研究尚处起步阶段,缺乏大规模临床验证,严重影响转化效率。
肿瘤异质性加剧了筛选难度。肿瘤分子异质性导致疗法疗效个体差异显著,如部分MTAP缺失患者因合并PI3K通路激活等变异,对PRMT5抑制剂无响应。且肿瘤分子特征随动态演化改变,进一步削弱静态标志物的预测价值,动态精准筛选成为临床难题。
复杂耐药机制制约长期疗效。PARP抑制剂耐药机制已明确,包括HR修复功能恢复、复制叉稳定性重建及药物外排增强等。新兴靶点抑制剂的耐药机制研究有限,但原发与继发性耐药问题将逐步凸显,深入解析耐药机制、开发逆转策略是实现长期获益的关键。
适应症局限限制应用范围。合成致死疗法目前聚焦BRCA突变、MTAP缺失等小众人群,此类突变在泛实体瘤中发生率低,受益人群有限。拓展至广谱实体瘤需突破靶点局限、挖掘泛癌种靶点,并开发有效联合方案,实现从精准治疗向广谱抗癌的跨越。
针对上述挑战,联合治疗、新型生物标志物开发、AI辅助靶点发现等方向成为合成致死疗法突破瓶颈的核心路径,为其向广谱抗癌升级提供了新的解决方案。
联合治疗凭借机制互补增强活性,是拓展合成致死疗法应用的核心策略。PARP抑制剂与化疗、抗血管生成药物、免疫治疗的联合方案已进入临床验证,奥拉帕利联合贝伐单抗、卢卡帕利联合阿比特龙均展现出明确疗效与安全性。新兴靶点抑制剂联合治疗前景广阔,ATR抑制剂联合放疗可提升肿瘤放射敏感性,PRMT5抑制剂联合免疫治疗能增强免疫细胞浸润,多机制协同可突破单一疗法瓶颈、扩大适应症。
新型生物标志物开发是破解患者筛选难题的关键。依托多组学技术可解析肿瘤分子特征,挖掘潜在标志物,如HRR通路缺陷相关标志物可辅助BRCA1/2突变人群筛选。循环肿瘤DNA(ctDNA)、外泌体等液体活检标志物,可实现肿瘤分子特征动态监测,为治疗调整提供依据,支撑合成致死疗法精准应用。
AI技术为合成致死靶点发现与药物优化提供高效工具。通过算法挖掘海量生物数据,可快速筛选靶点、预测协同关系,英矽智能已借助AI实现靶点识别与候选化合物优化,大幅提升研发效率。同时,AI可模拟药靶相互作用、预测临床试验结果,优化药物特性并降低研发风险,加速疗法临床转化。
展望未来,合成致死疗法有望通过多技术融合与多策略协同,实现从精准治疗向广谱抗癌的跨越。随着肿瘤分子机制研究的深入,更多泛癌种合成致死靶点将被挖掘,新型生物标志物体系逐步完善,结合AI技术与联合治疗策略,可实现患者的精准分层与疗效提升。然而,这一目标的实现需科研机构、药企、临床医生及监管部门的协同发力,加强基础研究与临床转化的衔接,优化临床试验设计,完善监管体系,推动合成致死疗法的规范化、规模化应用,最终为更多肿瘤患者带来长期生存获益。

 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2026-01-26
2026-01-26
 114
114

 产业资讯
产业资讯
 Medaverse
Medaverse  2026-02-02
2026-02-02
 2
2
 产业资讯
产业资讯
 丁香园Insight数据库
丁香园Insight数据库  2026-02-02
2026-02-02
 3
3