 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2025-12-16
2025-12-16
 283
283
如果体内CAR-T领域能够提供证明长期安全性和有效性的临床数据,那将带来一种更快、更便宜、更简单的CAR-T疗法。
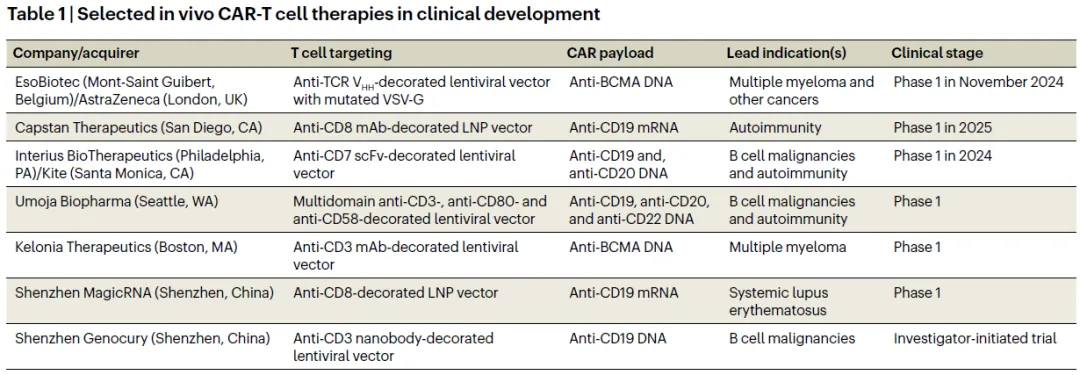
随着交易的不断增加,体内CAR-T(in vivo CAR-T)疗法有望颠覆细胞治疗领域。过去一年里,制药巨头一拥而上,纷纷在体内CAR-T赛道重金下注,包括阿斯利康以10亿美元收购EsoBiotec,艾伯维以21亿美元收购Capstan,吉利德旗下公司Kite以3.5亿美元收购Interius以及BMS以15亿美元收购Orbital。随着两大技术路线(慢病毒及LNP-RNA)越来越多的管线进入早期临床,该领域目前正在等待进一步的临床概念验证。
表1 部分处于临床开发阶段的体内CAR-T管线
自2017年诺华的Kymriah (tisagenlecleucel)和Kite的Yescarta (axicabtagene
ciloleucel)首次获批上市以来,CAR-T细胞疗法已经改变了肿瘤学家治疗B细胞恶性肿瘤的方式,包括滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤、急性淋巴细胞白血病和多发性骨髓瘤。截至目前,全球已有数万患者接受了CAR-T细胞治疗。
目前,所有已经获批上市的CAR-T产品及大部分在研CAR-T管线都是体外(ex vivo)生产的,需要患者前往医疗中心,提取淋巴细胞,然后再把细胞运送到生产地。之后,患者的细胞经过基因修饰改造,成为CAR-T细胞,再进行扩增。大约几周后,患者再到医疗中心,将体外生产的CAR-T细胞回输到体内,发挥治疗作用。
体内CAR-T疗法提供了一种诱人的简单替代方案:利用慢病毒载体或者LNP-RNA技术将CAR的“遗传指令”直接递送到患者体内,让CAR-T细胞在患者体内直接产生。与体外生成CAR-T相比,体内CAR-T治疗患者无需清淋(保留了患者的免疫系统,提升了安全性)、生产更简单、现货、治疗流程简化。“拥有一种真正现货型药物,就像可以在门诊使用的产品一样,是我们的梦想。”Capstan的Haig Aghajanian说道。
就递送而言,现在有两种主要的技术在争夺先发优势:一种是永久的,一种是暂时的。前者借鉴体外生成CAR-T,采用慢病毒载体,支持持久的CAR基因表达,尤其是用于癌症治疗;后者处于发展早期,利用LNP递送编码CAR的RNA,表现为相对短暂的CAR表达,对于自免疾病,安全性更高。
吉利德/Kite全球研究主管Priti Hegde表示:“就概念验证而言,慢病毒载体更加‘稳健’,但我们也非常热衷于探索LNP平台。”
对于肿瘤学资深人士来说,体内CAR-T疗法一个重要优势在于可扩展性和可及性。Umoja的联合创始人、CTO Ryan Crisman曾帮助将体外生成CAR-T细胞疗法Breyanzi推向市场,他表示,尽管有效,但只有大约20%的病人真正得到了这种救命药。
EsoBiotec(被AZ收购)、Interius(被吉利德收购)、Umoja、Shenzhen Genocury(济因生物)、Kelonia、Exuma等体内CAR-T先驱公司专注于慢病毒技术路线。EsoBiotec创始人、CEO JP Latere认为,体内生成CAR-T的挑战是如何特异性地转导足够的T细胞,并以尽可能高的效率。“最终,希望生产出一种尽可能与体外生成CAR产品相似的体内CAR产品。”他说。Crisman对此表示赞同:“从肿瘤学的角度来看,慢病毒载体是一种非常好的方法,因为它们具有稳定的整合性和非常好的持久性。”
不过,持久性并不是没有“坏处”。整合慢病毒载体会带来插入突变和继发性恶性肿瘤的潜在风险。为了减少这种可能性,最新一代的慢病毒被广泛改造。
Capstan(被艾伯维收购)、Immorna(嘉晨西海)、Shenzhen MagicRNA(虹信生物)、Aera Therapeutics、Stylus Medicine等公司正在开发基于LNP-mRNA的体内CAR-T产品;Oma、Orbital(被BMS收购)、Strand Therapeutics等公司则正在探索基于环状RNA的体内CAR产品,环状RNA被认为寿命更长,表达更高。
Capstan围绕一种新的LNP平台,专注于自免疾病。该平台的关键创新包括一种核心脂质(L829),专门设计用于避免肝脏摄取和快速降解;还包括一种偶联anti-CDs mAb。Aghajanian补充说,用这种T细胞靶向抗体修饰纳米颗粒“进一步减少了肝脏摄取” 。在食蟹猴体内重复注射携带抗CD20 CAR mRNA的CD8靶向LNP,诱导了长达一个月的B细胞消耗,清除了记忆B细胞,并允许naive-dominant B细胞重建,这是风湿病学家梦寐以求的“免疫重置”。
虹信生物利用CD8靶向LNP(包含可电离脂质ILB-3132)递送抗CD19 CAR mRNA。今年9月,该公司报告了来自5名系统性红斑狼疮患者的I/II期临床数据。研究结果显示,患者表现出快速的B细胞清除和可接受的耐受性,不过长期响应仍有进步空间。Aghajanian认为,B细胞清除需要更加深入,组织范围更广(包括三级淋巴结构),以实现持久的疾病控制。
对于将体内CAR-T用于自免疾病治疗,领域内也存在一些观点分歧。Aghajanian认为,早期、高水平的CAR表达就足够了,且比长期CAR表达更安全;Latere则认为,CAR持久性表达依然是关键。
未来,脂质化学将是优化特异性递送、降低免疫原性和和重新给药的关键。Hegde直言不讳地说:“对于基于LNP的产品,公司必须显示出在2-3周内真正重复给药的能力。如果产品半衰期很短……而且不能重复给药,这将是一个问题。”Aghajanian乐观地认为,Capstan的生物可降解脂质和去靶向设计将允许真正的重复给药。
接下来,无论是哪种技术路线的临床证据都有可能在一夜之间重塑竞争格局。
过去一年多,EsoBiotec和济因生物公布了基于慢病毒载体的体内CAR-T的早期临床数据。在多发性骨髓瘤中,EsoBiotec在中国进行的早期体内pilot试验表明,在没有进行清淋的前提下,慢病毒载体能够在24小时内在骨髓中转导组织驻留T细胞,并触发快速的靶向活性。济因生物去年10月也公布了早期概念验证数据。在一项IIT研究中,其CD19靶向体内CAR-T疗法使一名弥漫性大B细胞淋巴瘤患者获得完全缓解。此外,患者未出现2级以上细胞因子释放综合征或神经毒性(ICANS)等CAR-T治疗常见副作用。
投行William Blair的分析师Sam Corwin认为,该领域仍有持续并购活动的空间,预计会有更多的大型制药公司进入体内CAR-T赛道。
未来一个重要的关注点将是“大规模生产”。虽然基于LNP-mRNA的新冠疫苗已被证明可大规模生产,但抗体修饰的、特异性位点偶联的靶向LNP是另一回事。“将抗体‘放在’LNP上的复杂性是完全不同的。” Aghajanian说道。
慢病毒体内CAR-T玩家面临CMC挑战(生产细胞株、高滴度纯化、复制能力病毒检测),但他们认为,总的来说,产品成本将大大低于定制的体外生产CAR-T细胞疗法。
Latere称EsoBiotec一直着眼于生产。公司以过去20年大规模生产的慢病毒载体——第三代水泡性口炎病毒糖蛋白(VSV-G)假型化自灭活(SIN)慢病毒载体为“起点”,仔细地对VSV-G进行诱变以缩小趋向性,并添加靶向T细胞受体(TCRαβ)的纳米抗体(Vin)以进一步提高特异性,但始终注意保持可扩展性。
目前整体而言,在体内CAR-T赛道,市场的行动速度快于数据的产生速度,不过数据也正在快速诞生。Corwin认为,明年将获得一些关键问题更多的回答:1)不进行清淋,整合病毒载体的持久性能否达到体外生成CAR-T水平?2)靶向LNP能够在几天后安全地重复给药吗?3)肝脏和脾脏在实际生产中真的去靶向化了吗?。她说:“如果数据积极,我们将看到大型制药公司继续进行投资和收购活动。我们期待在接近2030年时,有体内CAR-T产品能够实现商业化。”

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 44
44

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 46
46

 产业资讯
产业资讯
 生物制药小编
生物制药小编  2026-01-19
2026-01-19
 46
46