 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-12-20
2025-12-20
 7
7
2025年对于生物制药行业来说仍然是充满挑战但又不乏曙光的一年。面对盈利目标落空、融资成本飙升和监管不确定性加剧带来的重重困难,药企管线的含金量仍在持续上升,各新型疗法进入收获期,凭借对颠覆性技术的持续探索,各家药企仍在致力将创新疗法更好更快地推向市场。
本文将回顾今年最具意义的5项临床试验关键进展,探讨其对公司和行业的广泛影响。
01
uniQure亨廷顿病疗法:
疾病延缓75%,30余年无药困局迎希望
亨廷顿病(Huntington's Disease,HD)是一种致命的常染色体显性遗传性神经退行性疾病,由HTT基因第1号外显子CAG重复序列异常扩增引起,导致突变亨廷顿蛋白(mHTT)毒性累积。患者通常在30-50岁发病,表现为不自主舞蹈样运动、认知衰退和精神症状,病程10-25年,最终因吞咽困难、肺部感染或心衰离世。目前无药可医,现有药物只能部分缓解运动症状,无法延缓或逆转疾病进程。
目前市面上仅有丁苯那嗪及其升级版氘丁苯那嗪两款症状缓解药物,治标不治本。此前,罗氏和lonis合作开发的反义寡核苷酸(ASO)疗法tominersen曾一度被寄予厚望,但因疗效不佳,其Ⅲ期临床试验GENERATION HD1于今年3月终止。当下市场主要关注的是uniQure的AMT-130和Wave Life Sciences的WVE-003(PNASO),而后者2024年公布的1期数据显示,多剂量给药下,24周后和28周后mHTT分别平均降低46%和44%。
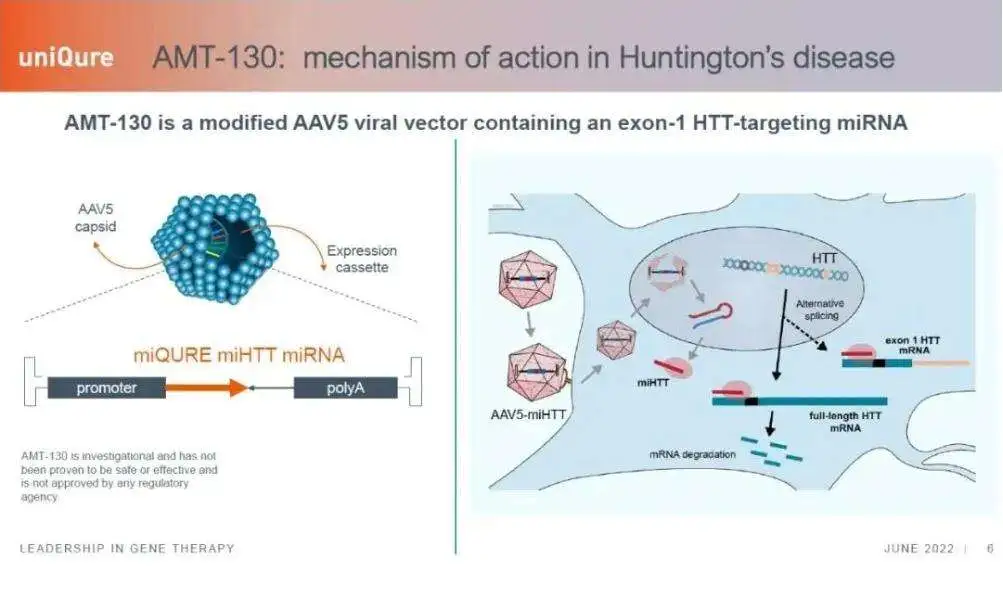
9月24日,uniQure公布了其AAV5递送的miRNA基因疗法AMT-130用于早期HD的1/Ⅱ期临床试验的长期随访结果。数据显示,其在安全性、关键生物标志物及多项临床评估指标上均表现出色,高剂量治疗效果可持续至治疗后三年,疾病进展显著减缓75%,以远超预期的数据结果达到主要终点,与此前公布的两年随访数据中的80%疾病进展减缓率也基本一致。此外,该药物还达到了关键的次要终点,经衡量生活自理能力的总功能能力(TFC)评估,与对照组相比,疾病进展显著减缓60%。其他临床指标上也呈现出有利趋势,整体耐受性良好,安全性特征可控。
AMT-130基于uniQure 专利miQURE基因沉默技术开发,采用AAV5为载体,将靶向亨廷顿基因的人工micro-RNA送至脑组织,通过抑制mHTT产生,实现对疾病根源的精准干预。该药预计于2026年提交BLA,若能顺利获批,则有望成为全球首个针对HD治疗的基因疗法。
但挑战仍存。首先是商业化压力,复杂的生产和递送工艺可能导致高昂的治疗成本,参照其他基因疗法、价格或成为AMT-130普及的障碍。其次是FDA的态度转变,uniQure本月再次表示,目前的Ⅰ/Ⅱ研究数据不太可能作为BLA申请的主要证据。公司正在仔细评估反馈意见,并计划紧急请求在2026年Q1与FDA举行后续会议。
02
Metsera GLP-1减重药:
部分数据超替尔泊肽,引MNC竞购的减重新星
2024年9月,聚焦肥胖症治疗的新兴选手Metsera宣布,其GLP-1注剂MET-097i在一项早期研究中于36天内实现了7.5%的减重效果,迅速引起了业界关注。今年,这家生物技术公司用实际行动证明了其成功并非偶然,并最终以近100亿美元的价格被收购。
传统GLP-1药物同时激活G蛋白和β-arrestin通路,可能引发副作用,而MET-097i则是一款采用偏向型激活机制的GLP-1受体激动剂,通过选择性激活G蛋白通路,提升疗效的同时规避脱敏问题,实现更优的疗效-安全性平衡。给药频率方面,该药的优势也十分明显。相较于需每周注射一次的诺和诺德的Wegovy和礼来的Zepbound、Mounaro,MET-097i仅需每月注射一次。
今年1月,Metsera公布了其la期临床试验数据。该试验纳入了120名超重或肥胖但未患2型糖尿病的患者,数据显示,经过12周的每周一次注射后,接受GLP-1注射的患者体重较安慰剂组下降了11.3%,且在12mg剂量组中个体反应高达约20%,并且没有观察到任何平台期效应。9月下旬,该司又发布了一项llb试验的数据,称1.2mg剂量组患者在28周时,安慰剂校正的平均体重减轻幅度高达14.1%。分析师指出,在类似随访期内,礼来的重磅药物替尔泊肽“安慰剂校正后体重减轻约为13%”。此外,该试验中,MET-097i个体最大减重幅度可达26.5%。研究延长期每周给药阶段(36周)结束时的探索性分析进一步显示,患者仍在显著减重,且尚未达到平台期。
此外,Metsera公司的超长效胰淀素注剂MET-233i也值得一提。6月公布的一项Ⅰ期临床试验数据显示,与安慰剂组相比,36天后接受MET-233i治疗的受试者体重减轻了8.4%,个别受试者的体重减轻幅度甚至达到10.2%。Metsera正加速推进MET-233i的相关研究,包括单药疗法以及与MET-097i的联合疗法。
9月中旬,辉瑞宣布将以企业价值49亿美元(每股47.50美元现金)收购Metsera,外加最高24亿美元的里程碑付款,潜在总对价达73亿美元。几项资产进展惨淡后,辉瑞此举竟在扩充其肥胖症领域管线,以此在潜力巨大的减重市场分一杯羹——辉瑞目前没有注射型减肥药,而口服药方面,由于肝脏安全问题,已先后停止了两种口服GLP-1候选药物lotiglipron和danuglipron的研发。
一个月后,诺和诺德半路杀出,提出企业价值60亿美元(每股56.50美元)、最高90亿美元的竞购报价。而Metsera笑纳竞价的态度更是加剧了这场混战。辉瑞迅速反击,一方面提升报价,另一方面发起诉讼,指控诺和诺德“滥用市场主导地位”,“绕过反垄断法”以“压制竞争”。这场拉锯战以辉瑞胜诉收场,最终报价企业价值70亿美元(每股65.60美元)叠加新的里程碑付款(最高每股20.65美元),以总价值约100亿的方案完成了对M的收购。

03
诺和诺德GLP-1/Amylin:
Ⅱ期数据亮眼,新一代减重药蓄势待发
尽管诺和诺德竞购失利,其口服胰淀素候选药物Amycretin的期数据仍以“竞争性”疗效助其在减重降糖领域赢回一局。
Amycretin是诺和诺德自主研发的一款新型长效共激动剂,能够同时激活GLP-1受体和胰注素(Amylin)受体。这种双重作用机制使其在减重和血糖控制方面具有显著潜力。
今年年初,诺和诺德公布其针对超重/肥胖症患者的Ⅰ/Ⅱa期试验数据,结果显示,36周后,服用20mg剂量的Amycretin组受试者体重降幅达22%(vs. 安慰剂组2%)。上月,该司公布该产品首次用于2型糖尿病的Ⅱ期试验结果。该试验旨在评估在448名二甲双胍联用或不联用SGLT2抑制剂作为标准治疗血糖控制不佳的2型糖尿病患者中,使用每周一次皮下注射或每日一次口服Amycretin的安全性和疗效。数据显示,36周后,皮下注射m组体重降幅达14.5%(vs. 安慰剂组2.6%),口服Amycretin治疗组患者则实现了10.1%的降幅(vs. 安慰剂组2.5%),而无论哪种给药方式,高剂量Amycretin治疗在36周时均未观察到达到减重平台期。
同时,Amycretin还能降低血糖水平(以糖化血红蛋白HbA1c表示),皮下注射组和口服组的最大降幅分别为1.8%和1.5%。
AmycretinⅡ期临床试验的成功,对诺和诺德的肥胖症管线来说无疑是一剂强心针。近来这家公司在临床和商业上双双遇冷。尽管重磅药物Wegow率先上市,但其市场份额却不断被礼来的Zepbound蚕食。去年12月,其新一代减重疗法CagniSema虽然在期REDEFINE1研究中达到了主要终点,但22.7%的减重效果远低于投资者预期,导致该公司市值蒸发约720亿美元。与此同时,在期EVOKE和EVOKE+研究中,司美格鲁肽未能显著延缓阿尔茨海默病的进展。尽管此前大家对该项目的预期并不高,但数据公布后,诺和诺德的股价仍旧下跌了约10%。

可以预见的是,这款产品将成为诺和诺德进展最快的高潜竞品,为进一步增长带来极大信心。目前,诺和诺德计划于2026年Q1启动皮下注射和口服Amycretin针对超重或肥胖成年人的Ⅲ期试验。此外,后续其还将推动GLP-1/GIP/GGG(联邦制药引进)、两款GLP-1/GIP/Amylin三靶点激动剂的临床开发,以进一步增强管线矩阵。
04
BMS/BioNTech PD-1/VEGF药物:
验证地域一致性疗效,瞄准双抗布局领先
PD-1/VEGF在当今癌症领域可谓最受关注的趋势之一。该疗法利用双特异性抗体结合并阻断两种受体,以独特的协同机制,迅速成为全球药企争相布局之选。去年9月,康方生物和Summit Therapeutics合作研发的依沃西单抗凭借显著的无进展生存期(PFS)获益,在针对晚期非小细胞肺癌(NSCLC)的头对头试验中战胜K药,让这一疗法一时更加声名大噪。
几个月后,BioNTech也加速进军这一领域。在此前战略合作的基础上,以高达9.5亿美元的价格直接收购了普米斯,从而完全拥有获得这家中国biotech的PD-1/VEGF双抗BNT327。这款药物由人源化的抗PD-L1单域抗体(VHH)与一个含有Fc-沉默突变的抗VEGF-A IgG1抗体融合而成,能够通过结合PD-L1恢复效应T细胞功能,同时中和肿瘤微环境中的VEGF-A。通过同时作用于这两个靶点,可以从多个角度对肿瘤进行抑制,一方面调节肿瘤免疫微环境,另一方面影响肿瘤的血管生成,从而实现更好的治疗效果,并有助于提高安全性。
这笔投资给BioNTech带来了丰厚回报。今年6月,BMS向BioNTech抛出橄榄枝,豪掷111亿美元获得该药的全球合作开发和商业化权利。临床方面,9月,该司公布了一项全球Ⅱ期临床试验的数据,结果显示, pumitamig(BNT327)与标准化疗联合使用,在广泛期小细胞肺癌(ES-SCLC)患者中取得了76.3%的确认客观缓解率(cORR),疾病控制率(DCR)则达到了100%,与此前在2025年欧洲肺癌大会(ELCC)上公布的在中国开展的Ⅱ期临床试验数据整体一致,现已获FDA治疗SCLC的孤儿药认定。

本月,其针对晚期三阴性乳腺癌(TNBC)治疗的全球期临床试验结果也已公布。数据显示,无论PD-L1表达水平如何,pumitamig联合化疗均取得了不俗疗效,cORR为61.5%,DCR达92.3%,同样证实了之前在中国开展一线TNBC
Ⅰb/Ⅱ期临床试验时观察到的治疗效果。
目前,BioNTech已将pumitamig推进至同一适应症的后期研发阶段,并开展了期临床试验ROSETTA-LUNG-01。为了验证其在不同患者群体中的疗效,该研究正在美国、英国、土耳其、中国、韩国和澳大利亚等多个地区招募患者,并计划在全球范围内开设更多试验中心。ROSETTA-LUNG-01预计将于2029年3月完成。
05
罗氏阿尔茨海默病疗法:
失败抗体获新生,临床进展助力重振旗鼓
在神经科学领域研究进展受挫是常事,2025年也不例外。许多公司在这一领域遭遇临床试验失败,而罗氏今年却在最棘手的适应症之一阿尔茨海默病(AD)上取得了关键胜利。
在AD治疗中,能够减缓神经退化的治疗方法相对较少。β-淀粉样蛋白(Aβ)是AD的关键病理特征之一,Aβ会异常聚集形成淀粉样蛋白斑块,干扰神经细胞之间的信号传递,导致神经细胞功能障碍和死亡。取得进展的关键之一在于提高穿越血脑屏障(BBB)、进入中枢神经系统的能力,进而实现Aβ斑块的清除。
2022年底,罗氏的Aβ抗体gantenerumab在两项Ⅲ期临床试验中均告失败,项目被迫终止。然而,通过采用其创新的脑穿梭药物递送技术“Brainshuttle”,罗氏以2+1的设计方式推出trontinemab,将gantenerumab与靶向转铁蛋白受体1(TfR1)的蛋白域融合在一起,利用脑血管内皮细胞上高表达的TfR1,通过受体介导的转胞吞(transcytosis)跨越血脑屏障,将更多的gantenerumab成功递送到中枢神经系统中,并在中枢通过抗体依赖的胞吞作用(ADCP)清除聚集的Aβ斑块。这种Brainshuttle技术使得trontinemab在低剂量下就能在中枢神经系统中实现高暴露量,从而更有效地清除大脑中的Aβ斑块,同时降低了因高剂量给药而带来的副作用风险。
从2023年的阿尔茨海默病临床试验会议(CTAD)开始,罗氏就陆陆续续公布出了trontinemab临床Ⅰ期爬坡的临床数据,引起不少关注。今年7月,该司在2025年阿尔茨海默病协会国际会议(AAIC)上公布了Ⅰb/Ⅱa Brainshuttle AD试验结果。数据显示,治疗7个月内,91%接受高剂量trontinemab(3.6mg/kg)治疗的患者在PET扫描中脑部淀粉样蛋白检测呈阴性,其中72%实现了淀粉样蛋白团块的“深度清除”,且副作用情况较现有抗淀粉样蛋白治疗更少、更轻。在本月初举行的2025 CTAD上,罗氏也再次报告了这种更低剂量、更少副作用、更精准进入大脑的临床表现。基于整体结果,罗氏已正式启动两个平行的 III 期研究(TRONTIER 1 & 2),以进一步验证其在早期阿尔茨海默病人群中的疗效与安全性。
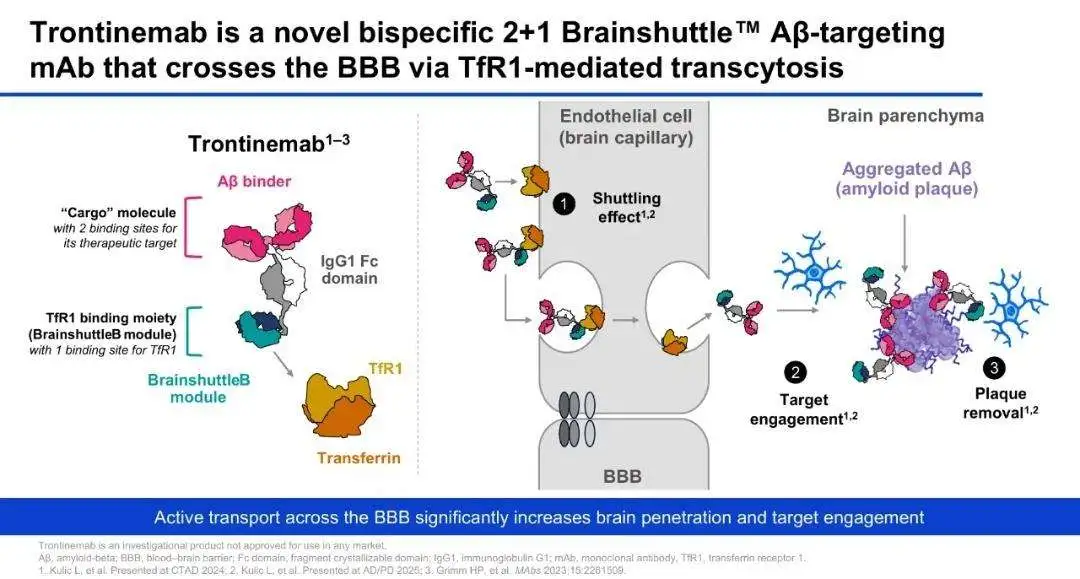
Trontinemab的早期数据不仅标志着罗氏逆转了AD领域的失败阴影,也意味着AD治疗四十余年的研究终于有望迎来关键成果。期待其Ⅲ期试验后续进展,为AD治疗带来切实有效的新选择。
结语
2025年,生物制药行业在重重挑战中砥砺前行,却也收获了令人瞩目的关键临床突破,相信未来将会有更多创新疗法涌现,为患者带来更多的治疗选择和希望,助力全球医疗水平迈向新的高度。

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 35
35

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 38
38

 产业资讯
产业资讯
 生物制药小编
生物制药小编  2026-01-19
2026-01-19
 38
38