 研发追踪
研发追踪
 佰傲谷BioValley
佰傲谷BioValley  2025-12-31
2025-12-31
 362
362
近日,Genmab公司宣布终止其PD-L1/4-1BB双抗Acasunlimab的进一步开发工作。
关于终止理由,Genmab表示,这一决定是基于“对整体竞争格局变化”的考虑,公司将把资源集中到更具潜力的后期临床管线,包括两款双抗Epkinly(CD3/CD20)、petosemtamab(EGFR/LGR5)以及一款ADC药物Rina-S(FRα)。
旨在克服肝毒性
Acasunlimab是Genmab基于DuoBody®平台开发的一款1:1结构的PD-L1/4-1BB双抗,旨在通过条件性激活T细胞和自然杀伤(NK)细胞上的4-1BB引起抗肿瘤反应。
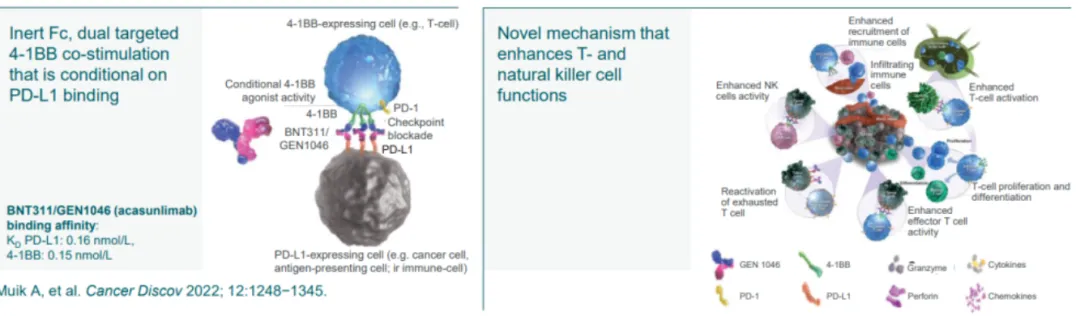
Acasunlimab的开发主要是为了克服4-1BB单抗严重的肝毒性问题。BMS和辉瑞都曾布局过4-1BB单抗,但分别因为肝毒性以及疗效有限而终止开发。
双抗或者联合用药就成了4-1BB靶向药一大主要开发方向。
Acasunlimab主要通过结合PD-L1阻断PD1/PD-L1免疫抑制通路,同时通过激活4-1BB下游免疫活化信号,从而起到解除免疫抑制和激活免疫系统的双重协同作用,最终扩大4-1BB靶向药的治疗窗口。
临床疗效如何?
从安全性来看,与BMS的Urelumab相比,Acasunlimab的肝毒性更为可控,但转氨酶升高事件依旧存在,且存在3级以上事件。在非小细胞肺癌II期临床中,三个给药组均出现了肝毒性报告,其中联用K药的Q3W组的肝毒性报告最多,Q6W组的疗效数据最好,肝毒性报告相对Q3W较少,但是仍然有3级以上事件。
而在疗效方面,Acasunlimab其实是难言令人满意的。2024年ASCO大会上,报告的Acasunlimab治疗经治PD-L1+(TPS≥1%)转移性非小细胞肺癌(NSCLC)的II期临床结果显示,Acasunlimab单药的确认ORR仅为13%。与K药联用的cORR为31%,6个月PFS率为33%。
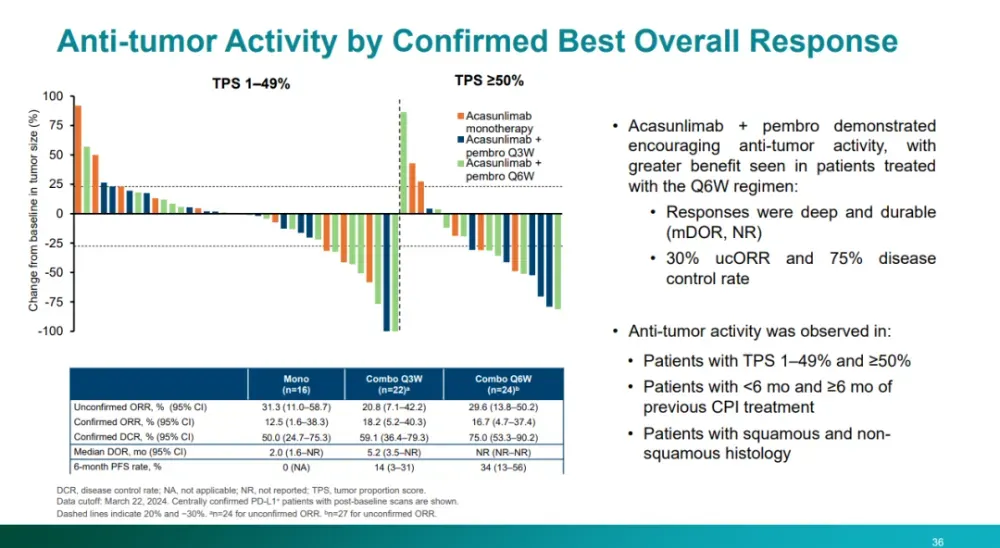
在这个临床数据公布的两个月后,合作方BioNTech便退还了Acasunlimab的开发权益。
Acasunlimab是全球临床进度最为领先的PD-L1/4-1BB双抗,也是唯一已进入临床III期的PD-L1/4-1BB双抗。
随着Acasunlimab的终止,在PD-L1/4-1BB双抗这个赛道上,国内药企就最为领先了。PD-L1/4-1BB这个双抗组合在国内相当热门,曾有相当多的企业布局开发(维立志博、齐鲁制药、祐和医药、科望生物、基石药业、百奥泰、BioNTech/普米斯生物、安科生物、德琪医药、科伦博泰、天境生物/ABL Bio)。维立志博和齐鲁制药相对较快,已经推进到临床II期阶段。

 研发追踪
研发追踪
 复宏汉霖
复宏汉霖  2026-01-13
2026-01-13
 69
69

 研发追踪
研发追踪
 细胞与基因治疗领域
细胞与基因治疗领域  2026-01-13
2026-01-13
 66
66

 研发追踪
研发追踪
 药明康德
药明康德  2026-01-12
2026-01-12
 151
151