 产业资讯
产业资讯
 药渡
药渡  2026-01-05
2026-01-05
 139
139
近日,Nature Reviews Drug Discovery发表了一篇关于肿瘤新靶点研究进展的文章,文章分析了自2011年以来处于研发阶段的抗癌候选药物及已获批药物的靶点情况。结果显示,多数进入研发后期的肿瘤药物并未涉及全新靶点,且潜在“首创新药”(FIC)的比例通常与研发阶段呈负相关。
在药物研发领域,一个新靶点的发现往往能催生出具有显著临床价值与广阔市场前景的创新药物。1999年,陈列平首次发现B7-H1(后称PD-L1),证实其具有抑制T细胞免疫的功能,并证明靶向PD-1/PD-L1的单抗能够恢复抗肿瘤免疫反应,从而奠定了免疫检查点抑制剂的理论基础。基于此研发的FIC药物帕博利珠单抗于2014年获批上市。截至2024年,该类药物的全球销售额已达到550亿美元,约占整个肿瘤药物市场的五分之一。

来源:Nature Reviews Drug Discovery
PART.
01
全新靶点药物
具备超高商业价值
根据GlobalData药品销售额及共识预测数据库的分析,2024年已上市的FIC肿瘤药物仅占上市肿瘤药物总数的31%,却贡献了41%的肿瘤药物营收,全球销售额达1190亿美元。这一数据充分表明,针对全新靶点的药物具有极高的商业价值。
PART.
02
全新靶点数量
随研发推进而减少
潜在FIC肿瘤药物在临床前研发阶段占比最高,达到57%。进入临床研发阶段(Ⅰ-Ⅲ期)后,该比例逐渐下降。其中Ⅰ期和Ⅱ期占比相近,分别为48%和49%,而Ⅲ期则显著下滑至34%。到提交上市申请阶段,该比例进一步降至25%。这一趋势反映出全新靶点药物研发风险较高,与成熟靶点候选药物相比,其在Ⅱ期和Ⅲ期临床试验中的失败率更高。
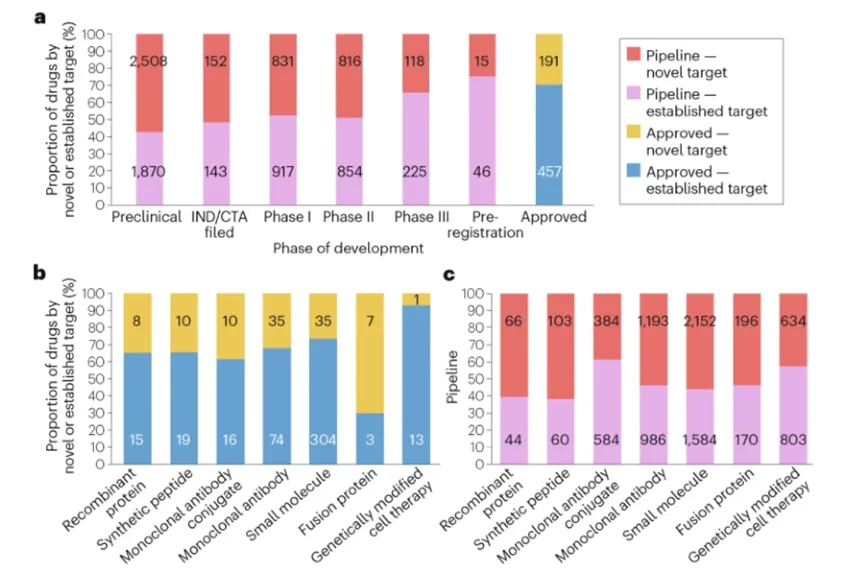
来源:Nature Reviews Drug Discovery
PART.
03
从药物类型
看全新靶点研发趋势
企业在开发全新靶点药物时,需选择最适合的药物类型。为降低研发与投资风险,企业与投资者通常倾向于两大方向:一是采用成熟的药物类型开发全新靶点,二是利用全新药物类型布局成熟靶点。
从已获批药物来看,不同药物类型的全新靶点占比差异显著,区间在10%至70%之间。需说明的是,部分药物类型因获批数量较少,可能放大这一差异。在两种成熟的药物类型中,小分子药物和抗体疗法(不含ADC)的FIC药物占比分别为26%和32%。而处于两极的是,已获批的基因修饰细胞疗法中全新靶点仅占10%,而融合蛋白药物中该比例高达70%。
从包括临床前在内的研发管线分析,各类药物的全新靶点占比在40%至60%之间。其中,ADC与基因修饰细胞疗法更倾向于靶向成熟靶点。ADC药物的这一特点源于其常见开发策略:在已获成功的单克隆抗体基础上,通过搭载毒性载荷等其他组件开发ADC,是一种已验证的重磅药物研发路径。典型案例包括靶向HER2的ADC药物恩美曲妥珠单抗与德曲妥珠单抗,两者均基于先驱单抗曲妥珠单抗的成功,进一步改善了HER2阳性转移性乳腺癌患者的治疗效果。
PART.
04
FIC药物的研发竞速
针对全新靶点的在研药物数量分布不均,通常在首款药物获批前,已有多个企业布局同一靶点。以CD137(又称4-1BB)为例,该靶点表达于活化的免疫细胞表面,目前已有42款靶向CD137的抗体类药物处于Ⅰ-Ⅲ期临床阶段,包括12款单克隆抗体和30款多特异性抗体(含双抗、三抗及四抗)。双特异性抗体药物常采用“成熟靶点+全新靶点”的组合策略,以实现双通路协同增效。
小分子候选药物中最受关注的全新靶点是CDK2,目前有17款相关候选药处于临床研发阶段。这反映出行业的一个重要期待:抑制CDK2有望靶向CCNE1扩增的实体瘤,并可能克服CDK4/6抑制剂治疗乳腺癌后产生的耐药问题。目前CDK4/6抑制剂已有三款重磅药物上市。
部分全新靶点尽管已有候选药进入Ⅲ期,甚至早期部分候选药在后期临床试验中未获成功,仍有大量候选药处于Ⅰ期阶段。例如先天性免疫检查点蛋白CD47,目前有22款靶向该靶点的Ⅰ期候选药,其中超过半数为新型双特异性抗体,其临床表现有望优于早期单抗药物。
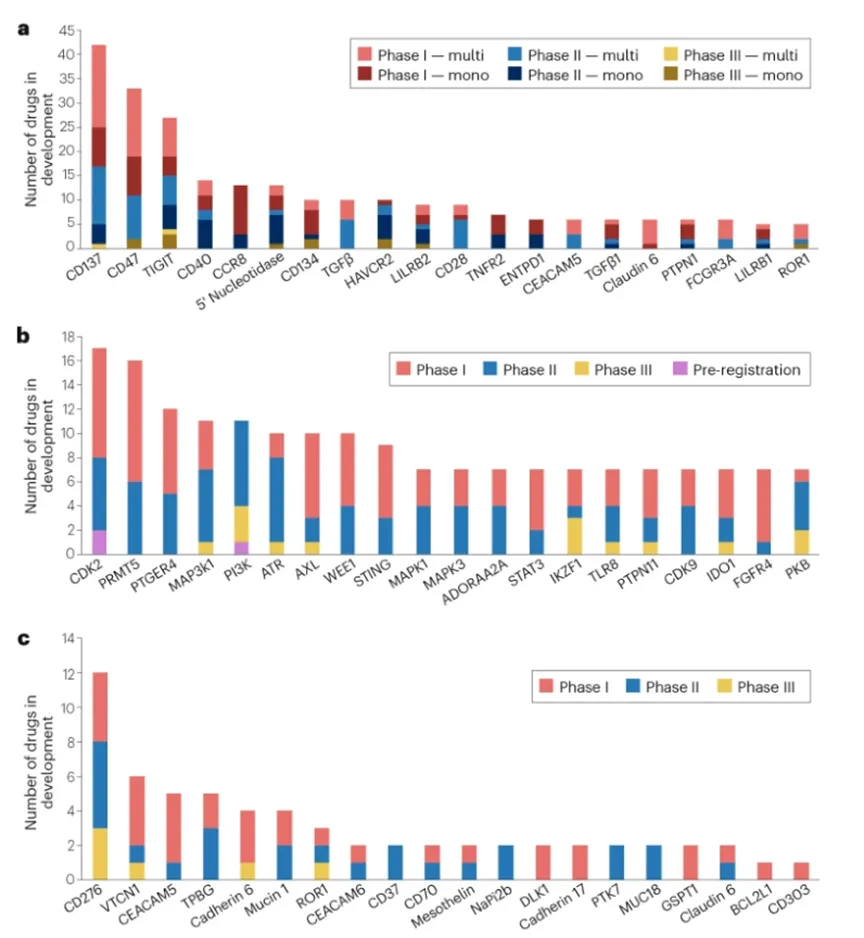
来源:Nature Reviews Drug Discovery
相较于其他药物类型,针对全新靶点开发的抗体偶联药物(ADC)数量明显较少。这与前文提到的ADC常见研发策略一致:企业更倾向于选择已有单抗药物获批的成熟靶点(如HER2)来开发ADC。该策略的一个主要例外是靶向CD276(又称B7-H3)的ADC——目前已有12款候选药,其中3款已进入Ⅲ期临床。尽管此前靶向CD276的单抗研发均未成功,但在小细胞肺癌等实体瘤领域仍存在未满足的临床需求,推动了相关ADC药物的研发。
结 语
尽管FIC药物在营收中占比突出,但同类后续药物(第二款、第三款)的研发仍蕴藏巨大商业潜力。实际上,对于患者群体广泛的疾病,其市场规模足以支撑多款重磅药物共存。部分企业也会通过新路径挖掘成熟靶点的价值:或采用新药物类型,或沿用同类药物类型并重点优化其疗效与安全性。
FIC药物并非必然成功,例如阿斯利康的EGFR抑制剂吉非替尼,其峰值销售额仅为4亿美元;随后罗氏开发的二代EGFR抑制剂厄洛替尼峰值销售额突破15亿美元;阿斯利康再推出三代EGFR抑制剂奥希替尼,目前全球销售额已超60亿美元,呈现了“后来者居上”的态势。
FIC药物的研发竞争也可能导致大规模投资失利。近期典型案例是TIGIT抑制剂研发全军覆没:今年年初,仍有5款该类药物针对多种癌症开展Ⅲ期临床试验,后续均告失败。考虑到肿瘤药物临床研发成本高昂,这些项目的投入可能高达数十亿美元。由此可见,研发资源过度集中于少数高优先级全新靶点,可能导致巨额投入收效甚微,反而未能推动更多高风险、高回报的创新路径实现。

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 19
19

 产业资讯
产业资讯
 识林
识林  2026-01-19
2026-01-19
 21
21

 产业资讯
产业资讯
 生物制药小编
生物制药小编  2026-01-19
2026-01-19
 20
20