 研发追踪
研发追踪
 药渡
药渡  2026-01-08
2026-01-08
 197
197
2025年1月5日,国家药品监督管理局官网公示,百济神州自主研发的B细胞淋巴瘤2(BCL-2)抑制剂索托克拉片(Sonrotoclax)正式获批上市,同时斩获两项适应症:用于治疗既往接受过治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)成人患者,以及用于治疗既往接受过抗CD20治疗和BTKi治疗的套细胞淋巴瘤(MCL)成人患者。
这一里程碑式获批使索托克拉成为全球第三款、国产第二款BCL-2抑制剂,标志着百济神州在血液肿瘤领域管线布局取得重大突破,为复发难治性B细胞恶性肿瘤患者提供了具有同类最优潜力的新一代治疗选择。
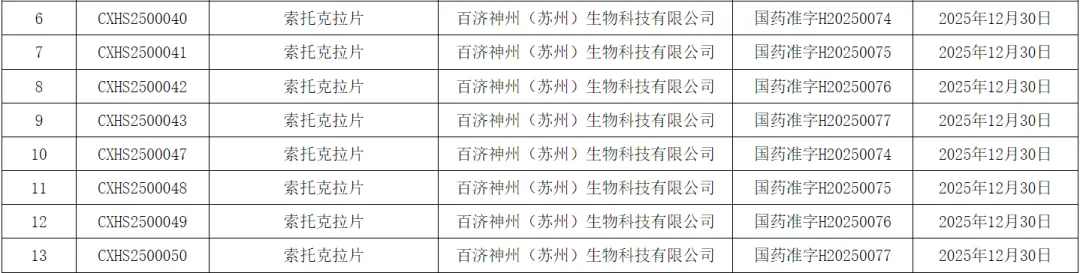
图1. 索托克拉片在华获批,来源:NMPA官网
PART.
01
新一代BCL-2抑制剂:
机制优化与药代动力学突破
BCL-2蛋白家族是调控细胞凋亡的关键因子,在多种B细胞恶性肿瘤中,BCL-2蛋白过度表达可抑制肿瘤细胞程序性死亡,导致其异常存活与耐药。靶向抑制BCL-2蛋白能够恢复肿瘤细胞的凋亡通路,已成为CLL/SLL、MCL等血液肿瘤的核心治疗策略。索托克拉作为百济神州自主研发的新一代选择性BCL-2抑制剂,其分子设计在多个维度实现了机制优化。
与传统BCL-2抑制剂相比,索托克拉具有强效性与高特异性,能够精准结合BCL-2蛋白的BH3结构域,阻断其与促凋亡蛋白的相互作用。最突出的药代动力学特征是其半衰期短且无蓄积特性,这一特点在联合用药与个体化剂量调整中具有重要临床价值。短半衰期使药物能够快速清除,在发生不良反应时可及时中断或减量,降低严重毒性风险;无蓄积特性则保证了长期用药的安全性,避免了药物在体内持续累积导致的潜在器官损伤。这些特性使其在临床实践中具备更灵活的管理空间,为高危患者或老年患者的安全用药提供了保障。
PART.
02
CLL/SLL适应症:
未尽之需与新希望
慢性淋巴细胞白血病与小淋巴细胞淋巴瘤是同一疾病的不同表现形式,约占成人白血病的三分之一,中国患者的中位生存期较西方国家更短,且更易出现疾病进展与复发。对于既往接受过BTK抑制剂、CD20单抗或化疗等多线治疗的复发难治患者,后续治疗选择极为有限,临床亟需高效低毒的新方案。
索托克拉在CLL/SLL中的获批基于一项开放标签、多中心II期注册研究BGB-11417-202(NCT05479994)的积极数据。该研究纳入100例既往已接受充分治疗的R/R CLL/SLL患者,中位随访14.4个月的结果显示,经独立评审委员会(IRC)评估,索托克拉单药治疗的总体缓解率(ORR)达76%,其中完全缓解(CR)或完全缓解伴骨髓造血不完全恢复(CRi)率为19%。中位至缓解时间(TTR)为3.7个月,表明药物起效迅速。
尤为关键的是,最佳外周血微小残留病不可检出(uMRD)率高达49.0%,达到uMRD4的中位时间为5.8个月。uMRD是评估CLL治疗深度缓解的重要指标,预示着更长的无进展生存期(PFS)与潜在的治愈可能。在IGHV未突变、存在17p缺失和/或TP53突变以及BTK突变等高危亚组患者中,ORR与CR率保持一致,证实其对预后不良患者同样有效。
安全性方面,索托克拉单药治疗耐受性良好,毒性可控且未发生临床肿瘤溶解综合征(TLS),整体风险获益比优异。
PART.
03
MCL适应症:
破解BTK抑制剂耐药难题
套细胞淋巴瘤兼具侵袭性淋巴瘤的进展快速与惰性淋巴瘤的不可治愈特点,中国发病率约为六十二万分之一,中位发病年龄约60岁,且随人口老龄化呈上升趋势。几乎所有MCL患者最终都会进展为复发难治状态,特别是接受BTK抑制剂治疗后耐药的患者,预后极差,中位生存期不足一年,治疗选择极为匮乏。
索托克拉在MCL中的获批基于全球多中心、单臂、开放性I/II期研究BGB-11417-201(NCT05471843)的完整数据。该研究纳入103例既往接受过抗CD20治疗和BTK抑制剂治疗的R/R MCL患者,接受320mg索托克拉治疗。结果显示,IRC评估的ORR为52.4%,CR率为15.5%,中位TTR仅1.9个月,中位PFS达6.5个月,中位DOR为15.8个月,数据尚未成熟。
尤其值得关注的是,在伴有TP53突变的高危亚组患者中,ORR仍达59.1%,表明其对最具侵袭性的MCL亚型仍保持强效活性。基于该研究的卓越数据,美国FDA已于2025年11月授予其优先审评资格,拟加速批准其用于BTK抑制剂经治R/R MCL的适应症,索托克拉有望成为美国首款获批的该领域BCL-2抑制剂。
PART.
04
全球竞品格局
目前全球范围内仅有三款BCL-2抑制剂获批上市。艾伯维的维奈克拉(Venetoclax)作为首款BCL-2抑制剂,已在美国、中国等地获批CLL/SLL、急性髓系白血病(AML)等适应症,2024年全球销售额达25.83亿美元,市场表现强劲。亚盛医药的利沙托克拉(Lisaftoclax)于2024年在中国获批,成为全球第二款、国产首款BCL-2抑制剂,目前主要针对R/R CLL/SLL患者。
索托克拉作为新一代产品,其差异化优势体现在多个维度。首先,半衰期短且无蓄积的药代动力学特征,在联合治疗与安全性管理上更具灵活性。其次,在MCL领域,索托克拉是全球首个在BTK抑制剂经治人群中展现明确疗效的BCL-2抑制剂,填补了该领域治疗空白。第三,其临床开发策略更具系统性,不仅覆盖单药治疗,更深度布局联合用药方案,与泽布替尼、奥妥珠单抗等药物的协同效应已在早期研究中显现。最后,百济神州依托其全球研发与商业化网络,已启动超过2,200例患者的全球开发项目,覆盖CLL、MCL、华氏巨球蛋白血症(WM)、多发性骨髓瘤(MM)、急性髓系白血病(AML)及骨髓增生异常综合征(MDS)等多个瘤种,适应症拓展潜力远超现有竞品。
结 语
百济神州索托克拉的双适应症获批,是中国创新药在血液肿瘤领域的又一重大胜利。作为全球第三款BCL-2抑制剂,其凭借独特的药代动力学优势、在MCL领域填补空白的临床价值以及深度布局的联合治疗战略,展现了成为同类最优药物的潜力。
从单药深度缓解到联合快速清除,从后线挽救治疗到前线挑战标准,索托克拉正在重新定义B细胞恶性肿瘤的治疗范式。这一成就不仅将改善我国数万CLL/SLL与MCL患者的生存预后,更将提升百济神州在全球血液肿瘤领域的核心竞争力,为其"让全世界患者都能用上好药"的使命写下坚实注脚。
随着后续研究的推进与全球化布局的深化,索托克拉有望成为继泽布替尼后,百济神州贡献给全球患者的又一重磅创新疗法,其临床价值与市场前景值得持续关注与期待。

 研发追踪
研发追踪
 复宏汉霖
复宏汉霖  2026-01-13
2026-01-13
 69
69

 研发追踪
研发追踪
 细胞与基因治疗领域
细胞与基因治疗领域  2026-01-13
2026-01-13
 66
66

 研发追踪
研发追踪
 药明康德
药明康德  2026-01-12
2026-01-12
 151
151