 研发追踪
研发追踪
 研发客
研发客  2026-01-12
2026-01-12
 147
147
• 针对疗效地区差异进行审评决策时,趋势、原因与风险/获益是FDA考量的关键因素;
• FDA通过加速批准给Voyxact放行,显著的蛋白尿降低是一大关键;
• APRIL靶向赛道竞争正迅速升温。
当一款全球新药在不同地区展现出明显疗效差异时,监管机构会如何抉择?近期获FDA加速批准的IgA肾病药物Voyxact(sibeprenlimab)为此提供了一个经典案例。
III期VISIONARY研究的中期分析显示,Voyxact治疗9个月时,蛋白尿降低幅度在亚洲组最大,达到56.5%,其次是欧洲组(54.1%)和南美组(37.1%),而北美组仅为25.6%。
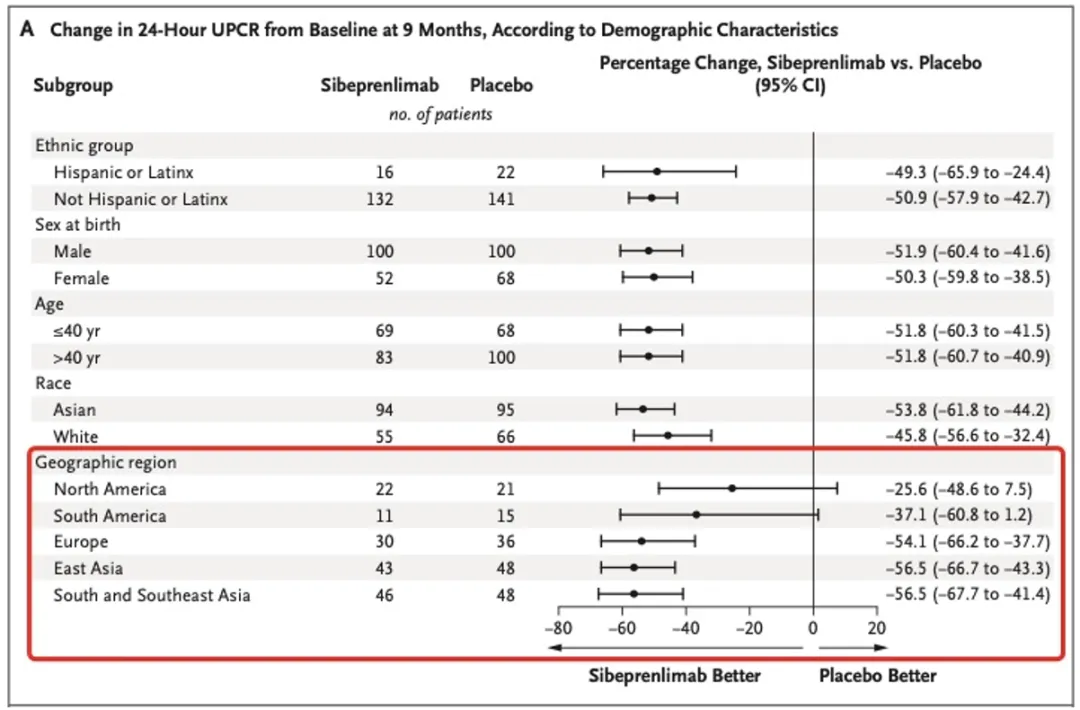
来源|NEJM
面对北美亚组看似腰斩的疗效数据,FDA依然做出全球首批的决定。这背后的审评逻辑是什么?是什么原因造成了这种疗效的地区差异?Voyxact的到来,又将如何影响IgA肾病的治疗格局?带着这些问题,研发客采访了前FDA资深临床审评员、礼邦医药首席科学官肖申博士。
FDA的决策逻辑
肖申首先指出,Voyxact呈现的北美数据不如其他地区并非个例。过去十几年,尤其在肾病领域也曾发生过多次类似情形。
比如,全球首个对因治疗IgA肾病的药物Nefecon(布地奈德),Ⅲ期临床研究NefIgArd的A部分显示,治疗9个月后,北美亚组蛋白尿减少24%,明显低于欧洲亚组的35%。

前FDA资深临床审评员、礼邦医药首席科学官
肖申博士
再如拜耳的Finerenone(非奈利酮)也在Ⅲ期研究汇总分析中显示,亚洲和拉丁美洲受试者的心血管复合终点风险降低幅度(20%和28%)高于北美(16%)和欧洲(约10%),且亚洲人群呈现更大的肾脏获益趋势。
“这种疗效地区差异并非是肾病独有,在心血管、代谢疾病领域也曾出现。”肖申解释,“心-肾-代谢是一个轴,它们彼此关联,互为因果,任何一个因素变化都会导致整个系统发生变化。”
尽管存在地区差异,但上述案例中的产品最终都获得FDA批准。相比之下,罗氏的CD3/CD20双抗glofitamab就没这么幸运。
2025年7月,FDA拒绝批准glofitamab治疗弥漫大 B 细胞淋巴瘤(DLBCL)的上市申请,原因之一就是亚洲和非亚洲地区患者生存数据存在不平衡。Ⅲ期Starglo试验亚组分析显示,亚洲地区试验组显著降低61%的死亡风险,但非亚洲国家试验组的死亡风险高出6%。除了OS,在PFS、ORR、CR率等指标上也观察到亚洲地区疗效更好的趋势。
总的来说,肖申认为,FDA面对这种疗效地区差异的决策逻辑和依据,首先是看趋势是否完全一致,比如是否同样都能降低蛋白尿、改善肾功能、降血压等。其次要看是什么原因导致的差别,以及这种差别有多大,能否解释和接受。最后是从获益与风险的角度,严格分析和综合评估这个药是否真正能够给美国病人带来获益。
疗效地区差异的原因
回到Voyxact的案例,肖申结合过去多年在FDA积累的审评经历,分析了可能造成其疗效地区差异的多个因素:
患者入组时基础条件:美国患者常伴有肥胖、糖尿病、心血管并发症等,病情相对较重;
治疗依从性:美国患者在按时按量用药,控制饮食、体重、血压等方面,通常做得不如亚洲病人好;
遗传因素:美国尤其是非裔病人,APOL1基因阳性率较高,而阳性意味着疾病进展更快,如IgA肾病、局灶节段性肾小球硬化、慢性肾功能不全、高血压肾病等;
样本量分布:在VISIONARY研究中,北美病人占比20%,而亚洲和欧洲占了80%,这种不平衡会放大随机误差,使得亚组分析结果易受偶然因素影响。
“比较放心的是,欧洲的效果跟亚洲较为一致,说明在数据完整性、数据造假等方面的担忧可以消除。”肖申进一步表示,要排除随机误差,有必要对美国内部不同中心的疗效进行比较。“如果有些中心差,有些中心好,这是能接受的,但如果每个中心疗效都差,说明是有问题的。”
肖申还特别强调,FDA对样本量的要求并非一成不变:“过去只要证明国外数据跟美国没有区别,即便美国入组病人少也可以获批。但现在这方面要求越来越严格,特别最近这五年,一定要有足够的美国病人数据。”
前述提及的罗氏双抗glofitamab,它被FDA拒绝批准的另一个原因正是美国患者数量有限。根据FDA在ODAC会议上的意见,尽管STARGLO整体研究结果达到了OS显著获益,但美国患者入组仅占意向治疗人群的9%。
GSK的BCMA ADC产品Blenrep也遭遇过类似情况。虽然高比例的眼部毒性、高频率的剂量调整是FDA反对批准的主要潜在问题,但美国患者入组率低也是一个关键缺陷,该药在关键DREAMM-7和-8研究中纳入的美国患者比例均低于5%。
IgA肾病五强角逐
FDA通过加速批准给Voyxact放行,这一决定背后无疑有多重考量,而显著的蛋白尿降低是一大关键。蛋白尿降低是公认的、与延缓肾衰竭进展相关的替代标志物,临床上常用UPCR(尿总蛋白/尿肌酐比值)作为24小时尿蛋白的替代指标。
在VISIONARY试验中,Voyxact治疗9个月时使得蛋白尿显著降低51%。单从数据来看,这一指标相比其他IgA肾病疗法略胜一筹:Fabhalta降低38.3%,Vanrafia降低36.1%,Filspari降低49.8%,Nefecon降低27%。
加速批准只是第一步,接下来的完全批准则取决于VISIONARY试验确证性研究结果的揭晓。对于这些即将在2026年读出的数据,肖申表示会重点关注两个细节:一是有效性上是否能够证明两年时延缓疾病进展(以估算eGFR下降衡量);二是安全性上会不会增加感染的风险,因为Voyxact通过减少抗体产生来抑制免疫系统。
从机制来看,Voyxact代表了一类全新的IgA肾病治疗药物:它是首个获批的APRIL靶向药物,区别于已上市的补体抑制剂Fabhalta(诺华)、糖皮质激素类药物Nefecon(云顶新耀/Calliditas)以及内皮素受体拮抗剂Vanrafia(诺华)和Filspari(BMS)。
APRIL在IgA肾病的发病机制中起关键作用,通过促进致病性Gd-IgA1的产生,成为该病进展的重要起始和持续因素。Voyxact由大冢制药全资子公司Visterra设计和开发,通过选择性结合并抑制APRIL,降低IgA、APRIL 和Gd-IgA1的水平,进而减缓肾脏损伤和进展至终末期肾病的进程。
与前四款产品均为小分子药物不同,Voyxact还是首个获批用于IgA肾病的生物制剂,它采用单剂量预充式注射器包装,每四周皮下注射一次,旨在方便患者自行给药。
“Voyxact属于first-in-class,理论上靶向APRIL可能作用更强,疗效更好。但通过靶向APRIL抑制B细胞的免疫功能,会不会对长期的安全带来影响?这是一个很重要的考量点。”在肖申看来,现在评价Voyxact对IgA肾病治疗格局的影响还为时尚早,最终还需要看两年后甚至更长时间内患者结局是否有明显差异。
APRIL竞速赛,荣昌错失良机?
APRIL靶向赛道竞争正迅速升温。除了Voyxact,诺华的抗APRIL药物zigakibart已进入Ⅲ期临床,另外还有多款BAFF/APRIL双重抑制剂已进入Ⅲ期/上市申报阶段,包括Vera Therapeutic的atacicept、Vertex的povetacicept、荣昌生物/ Vor Bio的泰它西普。
严格来说,早在2021年获批的泰它西普是首款获批的APRIL靶向疗法,它已在中国获批系统性红斑狼疮(SLE)、类风湿关节炎(RA)、全身型重症肌无力(gMG)三项适应症。2025年6月被Vor Biopharma合作引进后,泰它西普正在海外推进重症肌无力和原发性干燥综合征的后期临床,但针对IgA肾病的临床开发计划尚不明确。
自11月25日Voyxact获批以来,荣昌生物在科创板和港交所的股价均出现小幅度波动,并呈下跌趋势。这引发了不少人议论,认为与Vor Biopharma的合作并非明智之举,甚至拖慢了泰它西普的国际化进程。
对此,肖申特别强调合作伙伴的重要性。“选择合作伙伴跟公司本身大小关系不是很大,关键是对方是否在这个领域具备足够的能力、经验、人员和资源,以及是否能够全心全意真正推进产品,并遵照合同严格执行临床开发计划。”
相比单靶点抑制,以泰它西普为代表的双靶策略在带来获益升级的同时,但潜在风险也值得关注。
“IgA肾病分不同亚型,有些可能很快进展到肾功能恶化、肾衰竭,有些肾功能可以维持10~20年内没有太大变化。如果一款新药能强效控制蛋白尿,同时又有严重的免疫反应,那可能不一定适合IgA肾病患者。”肖申表示,单靶与双靶孰优孰劣,还要依据大样本的长期临床数据来审慎评估。
原链接:
https://www.otsuka.co.jp/en/company/newsreleases/2025/20251126_1.html

 研发追踪
研发追踪
 复宏汉霖
复宏汉霖  2026-01-13
2026-01-13
 64
64

 研发追踪
研发追踪
 细胞与基因治疗领域
细胞与基因治疗领域  2026-01-13
2026-01-13
 62
62

 研发追踪
研发追踪
 药明康德
药明康德  2026-01-12
2026-01-12
 146
146