 研发追踪
研发追踪
 IQVIA艾昆纬
IQVIA艾昆纬  2026-01-21
2026-01-21
 13
13
导读
癌症是全球面临的最严峻的健康挑战之一,每年影响着世界各地数百万人的生命。WHO 2024年的报告显示,2022年新增癌症病例达2000万例,死亡970万例,预计到2050年新增病例将达3500万例。长期以来,传统的癌症治疗手段往往是全身性的,缺乏特异性,导致诸多副作用。经过数十年的发展,治疗方式已显著转向更具针对性和个性化的疗法,抗体偶联药物(ADCs)作为癌症治疗的新兴手段应运而生。
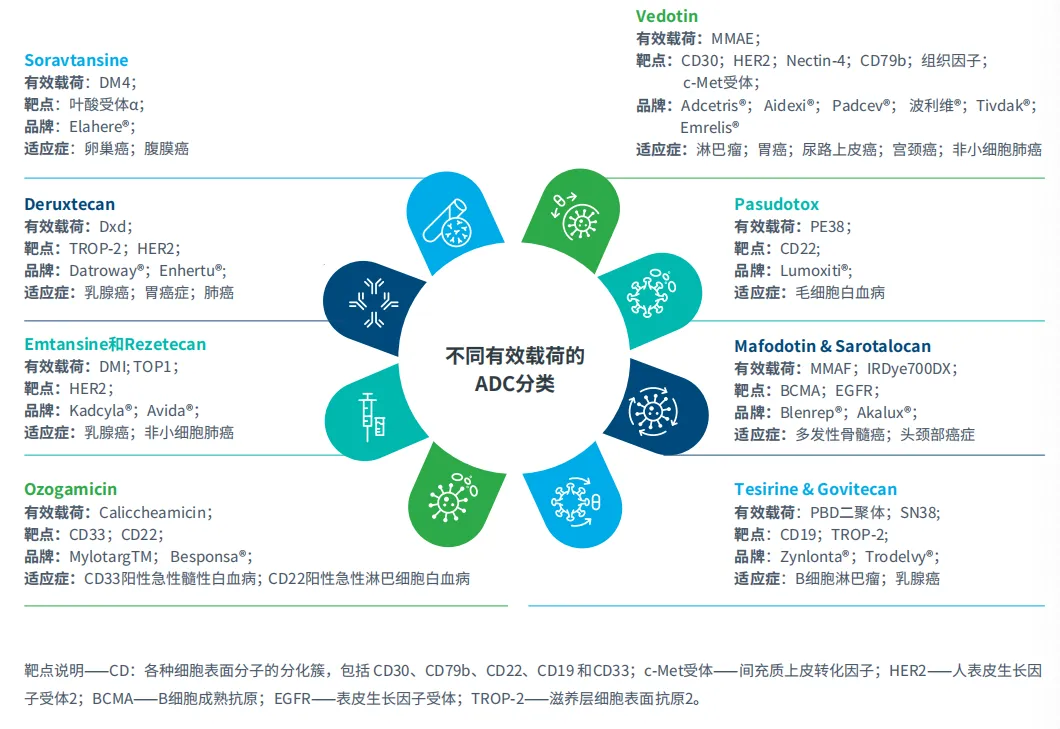
ADC是一种先进的疗法,它通过可裂解或不可裂解的连接子将单克隆抗体与强效细胞毒性药物(即有效载荷)连接起来。ADC能够通过识别特定抗原将药物直接递送至癌细胞,从而最大程度减少对健康组织的损害,并产生“旁观者效应”,杀死附近的肿瘤细胞。尽管前景广阔,但ADC的研发复杂且成本高昂,面临多种挑战诸如脱靶毒性和耐药性等。目前,已有15种ADC获批用于治疗多种癌症,包括乳腺癌、血液癌、胃癌、尿路上皮癌、宫颈癌和肺癌(图1),且约有200种ADC正在临床试验中,其中24种处于III期临床试验,这都得益于抗体、连接子和有效载荷技术的进步。如今,ADC已成为癌症治疗领域的变革者,市场需求不断扩大。
图1:不同类型已上市ADC的有效载荷、靶点、品牌及适应症
ADC的结构及作用机制
ADC由三个关键成分组成:单克隆抗体(mAb)、连接子和有效载荷。mAb通过其抗原结合片段(Fab)识别肿瘤相关抗原(T-Ag),并能触发补体依赖性细胞毒性作用(CDC)、抗体依赖性细胞毒性作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP)等免疫反应,诱导细胞凋亡或坏死(图2)。连接子将抗体与有效载荷连接起来,实现有效载荷的可控释放。
图2:ADC的四步骤作用机制
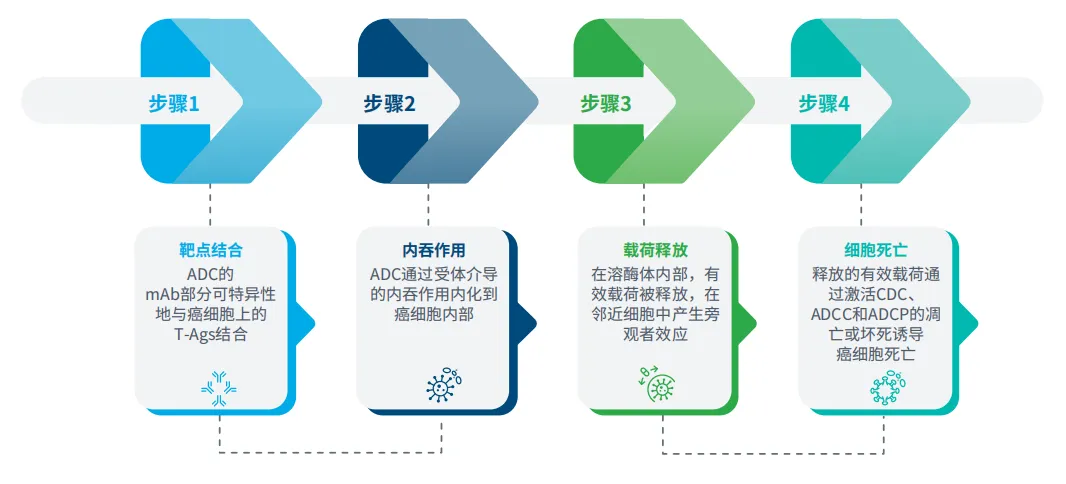
超过70%的ADC使用可裂解连接子,这些连接子在溶酶体的酸性或酶环境中断裂,例如Mylotarg和Enhertu®中的类型。Kadcyla®中使用的不可裂解连接子则具有更高的血浆稳定性,只有在癌细胞内吞后才会释放有效载荷。细胞毒性有效载荷是ADC的核心活性成分,涵盖多种药物类别。微管蛋白结合剂是最广泛使用的有效载荷,占已获批ADC的53.3%和处于III期临床试验候选药物的45.8%。其他有效载荷包括DNA损伤剂和拓扑异构酶I(TOP1)抑制剂。ADC的一个关键设计指标是药物抗体比(DAR),已获批的ADC中该比值通常在0到8之间,以平衡疗效和安全性。
ADC的发展
ADC已发展至第四代,每一代都在特异性、稳定性和效力方面有所提升(表1)。1975年杂交瘤技术取得进步后,医学家在早期的ADC中使用了鼠源抗体和基础连接子,为新一代ADC奠定了基础。第二代和第三代ADC引入了人源化抗体、位点特异性偶联以及强效有效载荷。
表1:ADC的发展
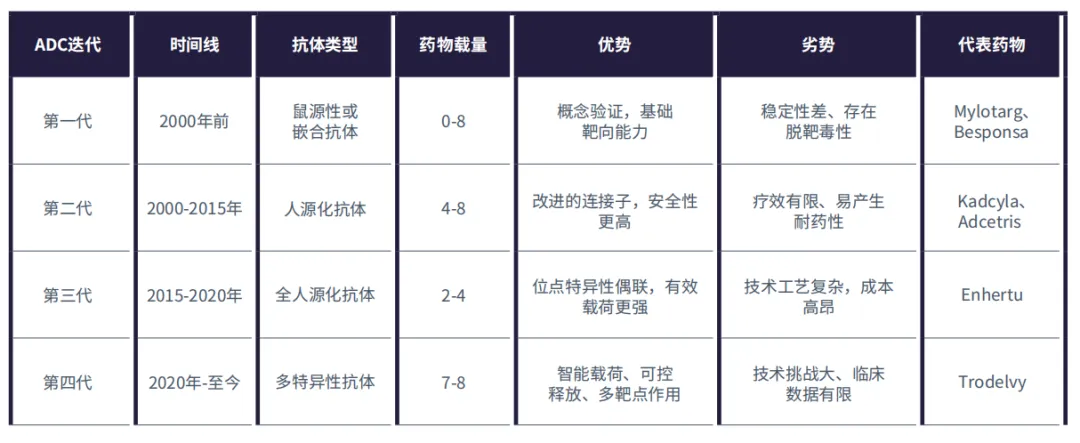
最新的第四代ADC,如Trodelvy®,具有比(DAR)、新型有效载荷以及双靶点策略,即使在耐药肿瘤中也能增强疗效。尽管取得了进展,但诸如复杂的偶联工艺以及对有效载荷的耐药性等挑战仍然存在。
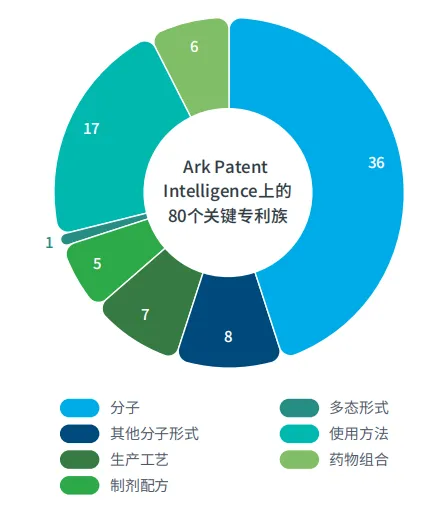
Ark Patent Intelligence数据中的ADC专利格局
根据IQVIA Ark Patent Intelligence数据,近年来全球ADC的专利格局显著拓展。截至2025年8月,全球已上市和已注册的ADC产品共有18种,约有80个关键专利族,仅分子专利就有超过36个专利族(图3)。
图3:Ark Patient Intelligence中不同ADC专利类型与族数量的关系
Ark Patent
Intelligence提供全球范围内的广泛信息,包括药品审批、市场洞察、关键专利、监管保护、诉讼趋势以及对已上市、已注册和处于III期临床试验阶段药品的深入分析。
案例分析一
Kadcyla和Enhertu的战略见解
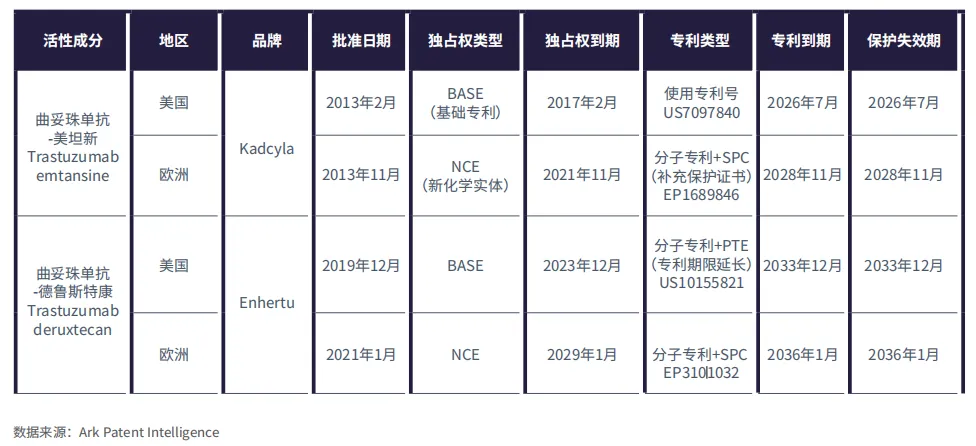
Kadcyla和Enhertu都是以Trastuzumab(曲妥珠单抗)为基础的HER2靶向ADC,但它们在有效载荷和连接子方面有所不同。罗氏旗下的Kadcyla(Trastuzumab emtansine)于2013年在美国和欧洲获批,采用的是DM1有效载荷和稳定连接子,用于治疗乳腺癌。相比之下,第一三共研发的Enhertu(Trastuzumab deruxtecan)于2019年在美国获批,2021年在欧洲获批,采用的是DXd有效载荷和可裂解连接子,用于治疗多种癌症,包括乳腺癌、肺癌、胃癌和实体瘤。
据Ark Patent Intelligence数据称,截至2025年8月,Kadcyla在美国的独家保护期于2025年2月到期,在欧洲已于2023年11月截止,其关键专利分别于2015年至2028年到期。这意味着生物类似药Trastuzumab emtansine获批不再有任何障碍;但最早也要到2026年才能在美国上市,2028年在欧洲上市。
相比之下,生物类似药Trastuzumab deruxtecan在欧洲最早2029年才能获批,在美国则要到2031年。Enhertu享有更长的专利保护期,其专利在美国有效期至2033年12月,在欧洲至2036年1月(表2)。这表明药企通过多样化组合抗体、连接子和有效载荷来创造新型ADC的潜力和机遇。例如,尽管原研Trastuzumab已不在专利保护期内,但各公司仍在其研发管线中推进创新的ADC变体,如Trastuzumab botidotin、Trastuzumab duocarmazine、Trastuzumab brengitecan等。与生产现有ADC的生物类似药相比,使用成熟的抗体开发新型ADC通常更具经济效益。此外,这些创新产品还能获得强有力的专利保护和更长的法律保护期,从而加大了生物类似药竞争对手进入市场的难度。
表2:Kadcyla和Enhertu在美国和欧洲专利及独占权到期情况
案例分析二
Adcetris和Polivy的战略见解
Adcetris®(本妥昔单抗维多汀,Brentuximab vedotin)和Polivy®(泊洛妥珠单抗维多汀,Polatuzumab vedotin)是血液瘤领域领先的ADC。两者均采用微管破坏剂MMAE作为有效载荷,可破坏微管结构并诱导细胞死亡。Adcetris由Seagen公司研发,分别于2011年和2012年在美国和欧洲获批用于霍奇金淋巴瘤(HL)和系统性间变性大细胞淋巴瘤。Polivy由Genentech公司研发,于2019年在美国获批,2020年在欧洲获批用于弥漫性大B细胞淋巴瘤(DLBCL)。
据Ark Patent Intelligence数据称,Adcetris在欧洲的独占保护期将持续到2023年10月,在美国将持续到2024年2月,其关键专利将于2026年至2027年间到期(表3)。另一方面,Polivy在欧洲的独占权将持续到2028年1月,在美国将持续到2031年6月。其在美国的分子专利将于2029年8月失效,而通过补充保护证书(SPC)延长的欧洲分子专利将一直有效至2033年7月。
表3:Adcetris和Polivy在美国和欧洲专利及独占权到期情况
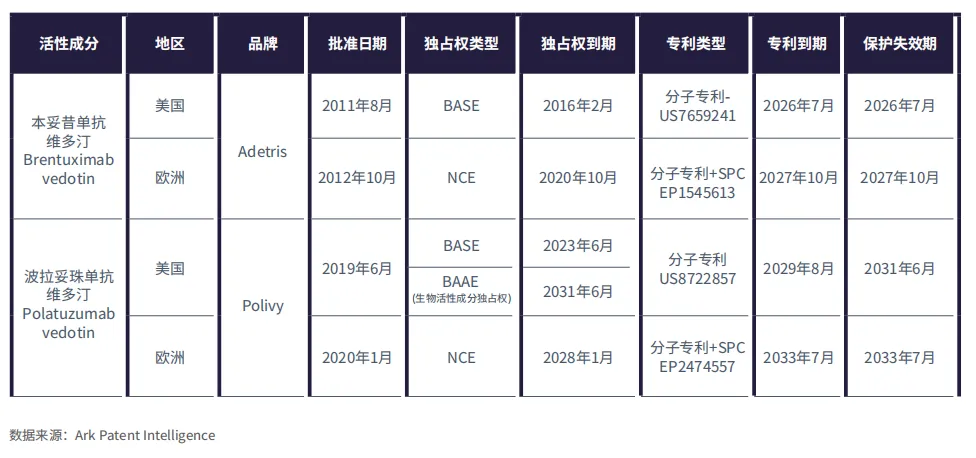
这表明,生物类似药本妥昔单抗维多汀Brentuximab
vedotin有望获批,尽管其最早在美国上市要到2026年,欧洲2027年。相比之下,生物类似药泊洛妥珠单抗维多汀Polatuzumab
vedotin最早也要到2028年才能在欧洲获批,2031年才能在美国获批,Polivy享有更长的专利保护期,其在美国的专利有效期至2031年6月,欧洲至2033年7月。
上述专利即将到期,将为生物类似药的竞争打开通道;然而,通过将不同的单克隆抗体与相同的连接子和有效载荷相结合来开发新的ADC,可能会带来诸如泰利妥珠单抗维多汀和恩诺单抗维多汀等创新疗法。这种做法可能会显著改变市场格局,使创新公司能够获得新的产品保护和竞争优势。
结论
ADC通过提供针对乳腺癌、胃癌和血液癌等疾病的靶向疗法,正在推动癌症治疗的发展。像Enhertu和Kadcyla这样的重磅药物彰显了其商业价值。尽管存在脱靶毒性、耐药性和高生产成本等挑战,但分子设计和稳定性的进步仍在不断改善其疗效。据Ark Patent Intelligence数据显示,Kadcyla在美国和欧洲的专利将于2026年至2028年到期,而Enhertu在这两个地区的专利保护期则延长至2033年至2036年。在淋巴瘤治疗方面,Adcetris和Polivy是可行的治疗选择。不过,Adcetris可能在2027年后面临生物类似药的竞争,而Polivy则享有更长的保护期。不断扩展的专利格局以及多样化的ADC组合为药企带来了新的机遇,也为患者带来了新的希望。

 研发追踪
研发追踪
 IQVIA艾昆纬
IQVIA艾昆纬  2026-01-21
2026-01-21
 13
13

 研发追踪
研发追踪
 氨基观察
氨基观察  2026-01-21
2026-01-21
 10
10

 研发追踪
研发追踪
 米内网
米内网  2026-01-21
2026-01-21
 11
11