 产业资讯
产业资讯
 药明康德
药明康德  2026-01-30
2026-01-30
 15
15
近日,美国FDA药物评价与研究中心(CDER)发布了该机构2025年新药审评年度报告。报告指出,FDA在新药审评与批准方面持续保持高效与稳定的节奏,围绕疾病的预防、诊断、治疗与治愈,推动了一批具有重要临床意义的创新疗法进入临床应用。这些获批药物覆盖多个疾病领域。本文将结合报告要点,带领读者了解生物医药监管领域的最新进展。

图片来源:123RF
FDA新药获批数量稳健
2025年,CDER共批准了46款新药。这些药物以新药申请(NDA)项下的新分子实体(NME)或生物制品许可申请(BLA)项下的新型治疗性生物制品形式获批,其活性成分此前均未获得FDA批准。2025年获批的新疗法覆盖传染病、神经系统疾病、疼痛管理、精神健康、心血管与血液疾病、肾脏与内分泌疾病、炎症、肺部疾病、过敏与免疫、肿瘤、眼科疾病以及女性健康等多个领域。
从2016年至2025年的十年数据来看,CDER平均每年批准约47款新药,2025年的批准数量与这一长期水平基本一致,反映出该机构创新药审评与批准体系的稳定输出。
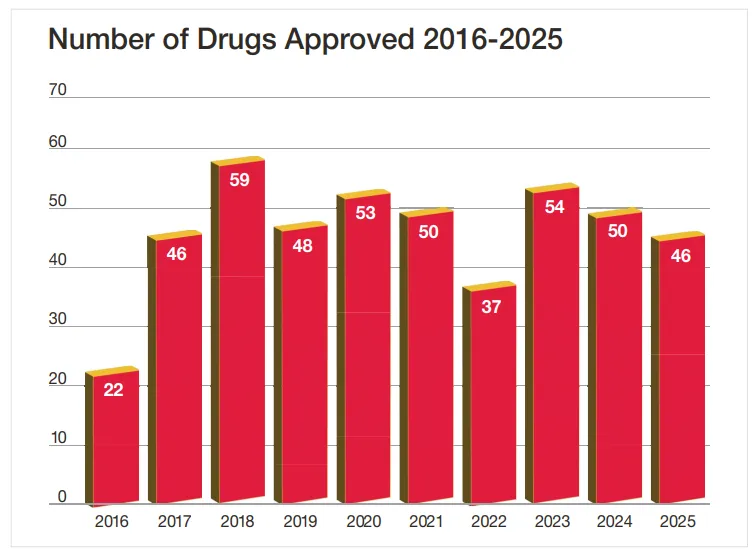
▲FDA自2016年至2025年批准的新药数量(图片来源:参考资料[1])
“First-in-class”疗法占比超40%
在2025年获批的新药中,共有20款属于“first-in-class”疗法,占比达到43%。这类药物通常代表全新的作用机制或治疗策略,能够突破传统治疗的局限,为患者提供此前尚不存在的干预手段。“First-in-class”药物的持续获批,也体现出药物研发在靶点选择、分子设计与临床转化方面的不断进步。
值得关注的例子包括:Blujepa(gepotidacin),用于治疗特定病原体引起的单纯性尿路感染,并随后获批用于治疗选择有限的单纯性泌尿生殖道淋病,这是近30年来首款用于治疗单纯性尿路感染的新机制口服抗生素;Brinsupri(brensocatib),用于治疗非囊性纤维化支气管扩张症;Dawnzera(donidalorsen),用于预防遗传性血管性水肿发作;以及Emrelis(telisotuzumab vedotin),这是首款获批用于治疗c-Met高表达、经治晚期非小细胞肺癌患者的疗法。
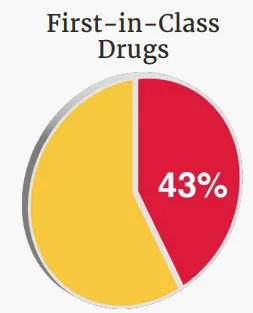
▲FDA在2025年批准的“first-in-class”疗法占比(图片来源:参考资料[1])
此外,Journavx(suzetrigine)作为非阿片类镇痛药用于中重度疼痛治疗,是20多年来首款用于急性疼痛的新机制药物;Nuzolvence(zoliflodacin)用于治疗单纯性泌尿生殖道淋病;Voyxact(sibeprenlimab)则用于治疗存在疾病进展风险的IgA肾病成人患者。这些疗法共同展现了2025年创新药物在多个治疗领域的突破。
罕见病药物获批占比一半
罕见病患者往往面临治疗选择有限甚至缺乏有效疗法的困境,因此新药研发具有尤为迫切的临床意义。由于患者人群规模较小、疾病机制复杂,罕见病药物开发通常需要投入更多科研资源与政策支持,而孤儿药资格机制正是推动这一领域创新的重要手段。
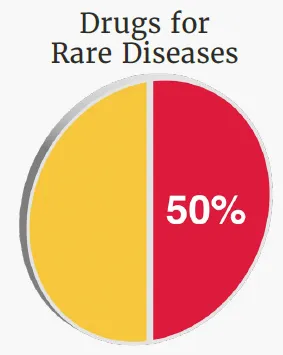
▲罕见病药物占2025年FDA批准新药的一半(图片来源:参考资料[1])
2025年,在46款新药中,有23款(约占50%)获得了孤儿药资格,靶向的罕见病包括巴思综合征、肢端肥大症、全身性重症肌无力、特发性肺纤维化和血友病等。同时,CDER还批准了多款用于罕见癌症或肿瘤的治疗药物,涵盖低级别浆液性卵巢癌、弥漫性中线胶质瘤、急性髓系白血病以及伴HER2(ERBB2)激活突变的非小细胞肺癌等适应证。这些批准进一步拓展了罕见疾病领域的治疗选择,也为相关患者群体带来了新的希望。
新药获批广泛应用加速审批途径
在加速创新药物上市方面,CDER在2025年广泛运用了多种加速开发与审评路径。这些机制旨在针对严重疾病或重大未满足医疗需求,提高研发与审评效率,使具有潜在临床价值的疗法能够更快进入患者可及范围。据统计,在2025年获批的新药当中,有72%的药物至少使用一种加速审批途径。
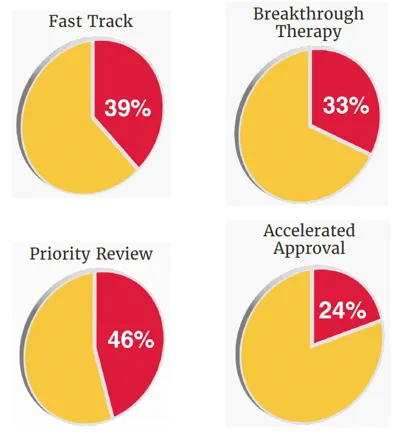
▲2025年FDA批准新药使用各类加速审批途径占比(图片来源:参考资料[1])
2025年46款新药中,有18款(39%)获得快速通道资格;15款(33%)曾获得突破性疗法认定,包括Avmapki Fakzynja Co-pack(avutometinib与defactinib)、Emrelis、Journavx、Voyxact等,其中Avmapki Fakzynja Co-pack为首款获批治疗KRAS突变型复发性低级别浆液性卵巢癌的组合疗法;21款(46%)获得优先审评资格,11款(24%)通过加速批准途径获批。值得一提的是,CDER在2025年对96%的新药(44/46)在PDUFA目标日期前或按期完成审评决定,且获批新药中有70%(32/46)为全球首批,凸显了FDA在创新药全球首次批准方面的重要性。
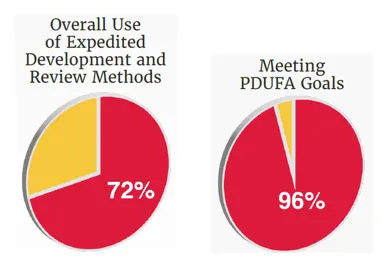
▲2025年FDA新药批准统计(图片来源:参考资料[1])
总体来看,2025年FDA在新药审批方面延续了数量稳定、结构多元的特点:既有覆盖广泛治疗领域的整体布局,也有在“first-in-class”疗法和罕见病药物上的持续突破。这既体现了监管体系对创新科学的支持,也反映了加速审批机制在实际运行中的重要作用。让我们期待在新的一年,更多新药好药能够获批上市,加速造福患者。

 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2026-01-26
2026-01-26
 69
69
 产业资讯
产业资讯
 药明康德
药明康德  2026-01-30
2026-01-30
 15
15

 产业资讯
产业资讯
 氨基观察
氨基观察  2026-01-30
2026-01-30
 16
16