 产业资讯
产业资讯
 医药地理
医药地理  2026-01-16
2026-01-16
 22
22
2026年伊始,医药领域的聚光灯便以令人目眩的速度聚焦于小核酸(siRNA)赛道。1月6日,赛诺菲宣布其靶向APOC3的siRNA药物普乐司兰钠在华获批,为特定遗传性高血脂患者提供了新选择,一年仅需四次给药。三天后的1月9日,国内小核酸领军企业瑞博生物成功登陆港交所主板,募资超18亿港元,其公开发售获超100倍认购,体现了全球资本对这一赛道的火热追捧;紧接着1月12日,中国创新药企尧景基因在全球顶尖的摩根大通医疗健康年会上,发布了全球首个心脏靶向小核酸递送平台“Kardia Shuttle”,突破了该疗法长期局限于肝脏的瓶颈;1月13日,千亿市值的港股制药龙头中国生物制药宣布以12亿元人民币全资收购国内拥有“一年一针”降血脂技术的siRNA公司赫吉亚生物,打响了国内该领域大型并购的第一枪。
短短一周内,从新药上市、资本狂欢到技术破壁、产业整合,一系列事件紧密交织,清晰地宣告:这场从基因层面根治疾病的“现代制药第三次浪潮”,已从技术探索的深水区,全速驶入产业爆发的白热化“卡位赛”阶段。
制药行业的三次浪潮
现代制药工业的演进清晰地划分为三次革命性浪潮。第一次浪潮(20世纪初起)以阿司匹林的广泛市场化为标志,代表了现代制药工业的起源。这一阶段主要依赖经验和筛选,发现了大批如青霉素等开创性药物,但其核心局限在于药物的作用靶点往往是未知的,犹如“黑箱”操作,难以系统地优化药效或预测副作用。
第二次浪潮(20世纪70年代起)则进入了理性设计时代,其核心范式是利用高通量筛选和基于结构的药物设计,针对明确的疾病相关蛋白质靶点进行开发。这一浪潮催生了今天广泛应用的小分子化学药和单克隆抗体等生物药,但它们作用的“舞台”主要局限于蛋白质层面,对于许多不具备传统“可成药”结合位点的靶点则束手无策。
当前,我们正身处由小核酸药物引领的第三次浪潮。与前两次有本质不同,小核酸药物是一种以核苷酸为基本单元的基因层面治疗药物。它不再直接靶向最终的蛋白质产物,而是像修改“生产图纸”一样,通过碱基互补配对原理,精准干预承载遗传信息的信使RNA(mRNA),从源头上调控致病蛋白的表达。
这一根本性变革带来了三大颠覆性优势:1. 靶点范围革命性拓宽:理论上,只要知道致病基因的序列,即可设计药物,攻克了此前大量“不可成药”的靶点,潜在可针对的靶基因超过2000个;2. 疗效持久性突破:其作用机制可实现长期乃至超长效治疗,例如已有药物可实现半年甚至一年给药一次,极大提升患者依从性;3. 研发路径更直接:相比于蛋白质结构的复杂性,针对已知序列设计核酸药物路径更清晰,研发成功率相对更高。
尽管仍面临递送系统等挑战,但小核酸药物正推动治疗范式从“修饰蛋白质”转向“编程基因指令”,有望在未来与小分子药、抗体药形成三足鼎立的新格局。

表1 现代制药的三次浪潮
从罕见病“救命药”到常见病“颠覆者”
Pharma ONE药物研发大数据平台显示,全球已获批29款小核酸药物(按通用名记,不含疫苗)。其中,普乐司兰与奥来泽生作为针对心血管代谢疾病的“新星”备受关注。普乐司兰是全球首个靶向APOC3的siRNA药物,可将罕见病家族性乳糜微粒血症综合征患者的甘油三酯水平降低达80%,且每年仅需皮下注射4次;奥来泽生作为同样靶向APOC3的ASO药物,旨在治疗更广泛的中重度高甘油三酯血症患者,二者展示了同一靶点下不同技术路径的探索。
另一个重要突破是血友病治疗领域迎来范式转变——全球首个用于血友病的siRNA疗法芬妥司兰,通过降低抗凝血酶水平重建凝血平衡,每年最少仅需注射6次,极大减轻了患者负担。与此同时,用于治疗遗传性转甲状腺素蛋白淀粉样变性多发性神经病的ASO药物依普隆特生,凭借其可让患者每月一次自行给药的便捷性,显著提升了治疗体验。
除此之外,诺西那生与英克司兰也堪称划时代的经典。诺西那生作为首个治疗脊髓性肌萎缩症的ASO药物,通过调控SMN2基因剪接成功开启了遗传病治疗的新时代,并成为当时最畅销的小核酸药物;而英克司兰作为首个成功进军常见慢性病领域的小核酸药物,以其靶向PCSK9、每半年仅需注射一次的长效优势,实现了行业在慢性病管理上的重要突破。
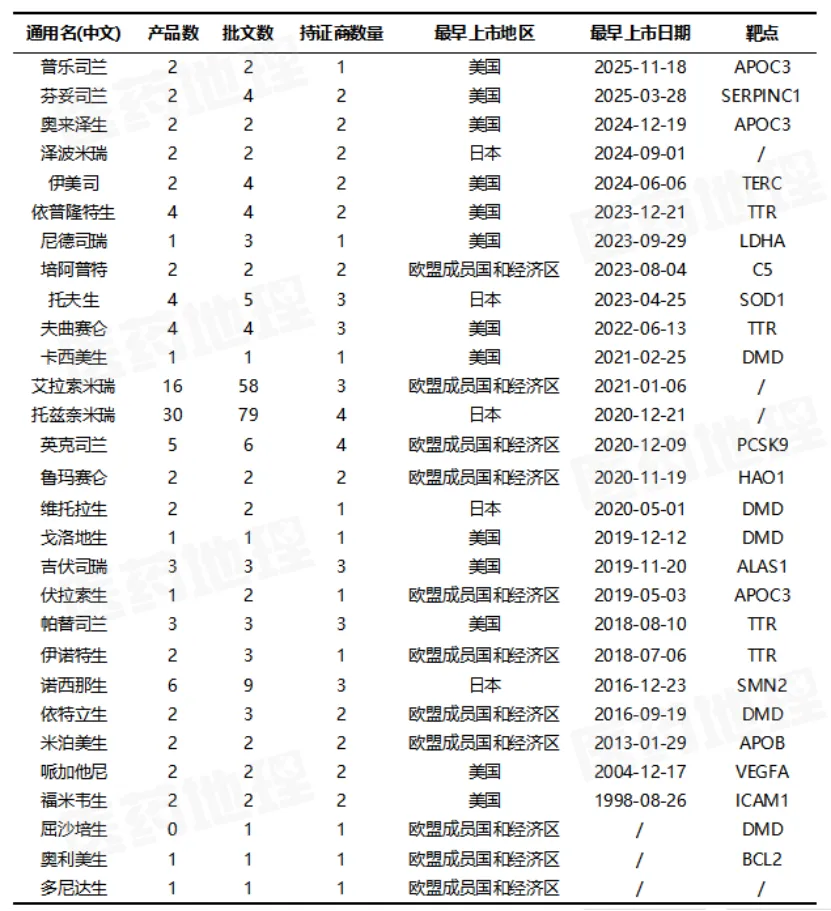
表2 全球已获批的小核酸药物
来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
未来四大核心赛道
随着技术成熟与资本持续涌入,当前小核酸药物四大核心赛道的竞争格局初步成形,共同指向一个更为广阔的未来。
01
心血管领域:已验证的基石市场
这是目前商业化最成熟、竞争也最激烈的领域,主要围绕降脂(靶向PCSK9、Lp(a)、APOC3)、降压(靶向AGT)和抗凝(靶向FXI)展开。国内企业中,瑞博生物的RBD4059(抗凝)已进入II期临床;赫吉亚生物针对Lp(a)的Kylo-11,其“一年一针”的构想则更具颠覆性。未来的竞争焦点将集中于疗效的头对头比较、给药周期的极限突破,以及与现有标准疗法(如他汀类药物)的联合用药价值。
02
减重与代谢:GLP-1浪潮后的新叙事
在GLP-1药物主导的当下,小核酸正讲述“下一代”故事。其策略主要有二:一是作为GLP-1的“增效拍档”,如Arrowhead公司的ALK7 siRNA与替尔泊肽联用,在临床前研究中显示出更好的减重与肌肉保留效果;二是开发全新机制,如圣因生物靶向INHBE的siRNA(已与礼来合作),旨在实现更精准的减脂。小核酸的目标未必是替代GLP-1,而是成为其最佳互补方案。
03
肾脏与补体疾病:2026年的潜在爆点
这已成为行业高度共识的潜力赛道。再生元的Cemdisiran、Ionis/罗氏的Sefaxersen等靶向补体通路的药物,预计将在2026年读出关键临床数据。国内企业如前沿生物布局了全球首创的MASP-2/CFB双靶点siRNA。除此之外,石药, 瑞博等企业也纷纷落子。鉴于肾病领域庞大的患者基数与高度未满足的临床需求,任何产品的成功验证都可能迅速催生新的重磅交易。
04
神经及肝外递送:定义天花板的终极疆域
这是技术壁垒最高、也最富想象力的前沿。诺华通过收购Avidity加码神经肌肉疾病,Arrowhead等公司则致力于突破血脑屏障,探索治疗帕金森病、阿尔茨海默病等。尽管多数管线尚处早期,但肝外递送,尤其是中枢神经系统递送技术的突破,将是决定小核酸市场最终天花板的关键。谁在此先取得稳定、高效的进展,谁就将掌握定义未来的钥匙。
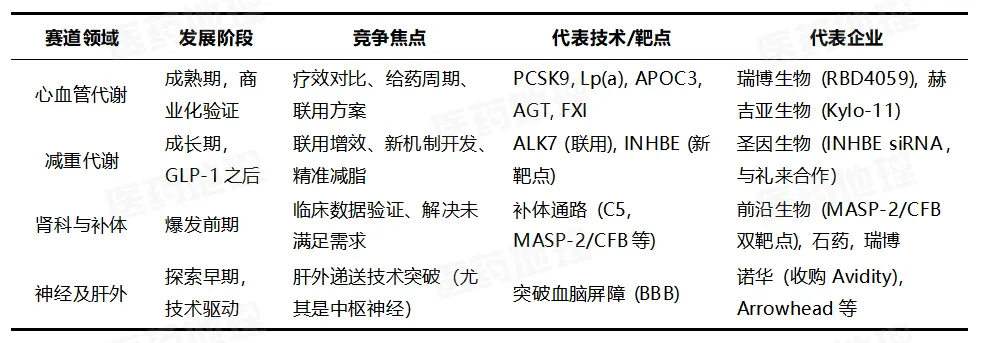
表3小核酸药物未来四大核心赛道
来源:Pharma ONE药物研发大数据平台,中国医药工业信息中心
谁能登上“新范式”的浪潮之巅?
小核酸的范式革命已势不可挡,但最终赢家远未确定,未来竞争将围绕三个核心维度展开:首先是平台厚度与迭代速度,即拥有如“乐高底座”般能灵活适配不同靶点与组织的模块化递送平台,将构成企业最深的护城河,单纯依靠单一技术或一两个单品,难以支撑长期价值。
其次是临床开发与商业化效率,技术优势必须转化为临床优势与市场份额,大药企对技术黑马的并购(如中国生物制药收购赫吉亚)正是为了融合创新能力与产业化能力,加速价值兑现。
最后是全球化与生态定义能力,竞争不止于产品出海,更在于能否凭借原创技术参与全球治疗指南制定与新疗法范式定义,从“资产售卖方”转变为“生态共建者”。
尽管肝外递送效率、长期安全性数据、生产成本与可及性等挑战犹存,但2026年初的行业浪潮已清晰表明,制药行业的第三次浪潮,正以远超预期的力度拍岸而来。这不是一个短暂的“风口”,而是一次深刻的 “技术-产业”双周期共振。

 产业资讯
产业资讯
 医药地理
医药地理  2026-01-16
2026-01-16
 22
22

 产业资讯
产业资讯
 科睿唯安生命科学与制药
科睿唯安生命科学与制药  2026-01-16
2026-01-16
 18
18

 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2026-01-16
2026-01-16
 18
18