 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-01-20
2026-01-20
 6
6
2026 年刚过去半个月,FDA 已经发出了多封完整回复函(CRL)。
1 月 8 日,FDA 再次拒绝了 Vanda 提交的 Hetlioz 用于治疗时差障碍综合征的上市申请,原因是研究模型过于理想化,相关数据不能提供实质性有效证据。
紧接着 1 月 9 日,首款同种异体 T 细胞疗法 Ebvallo 的 BLA 申请也第二次被驳回,FDA 认为其单臂临床数据不足以支持加速批准,且试验设计、设计和数据分析方面存在问题。
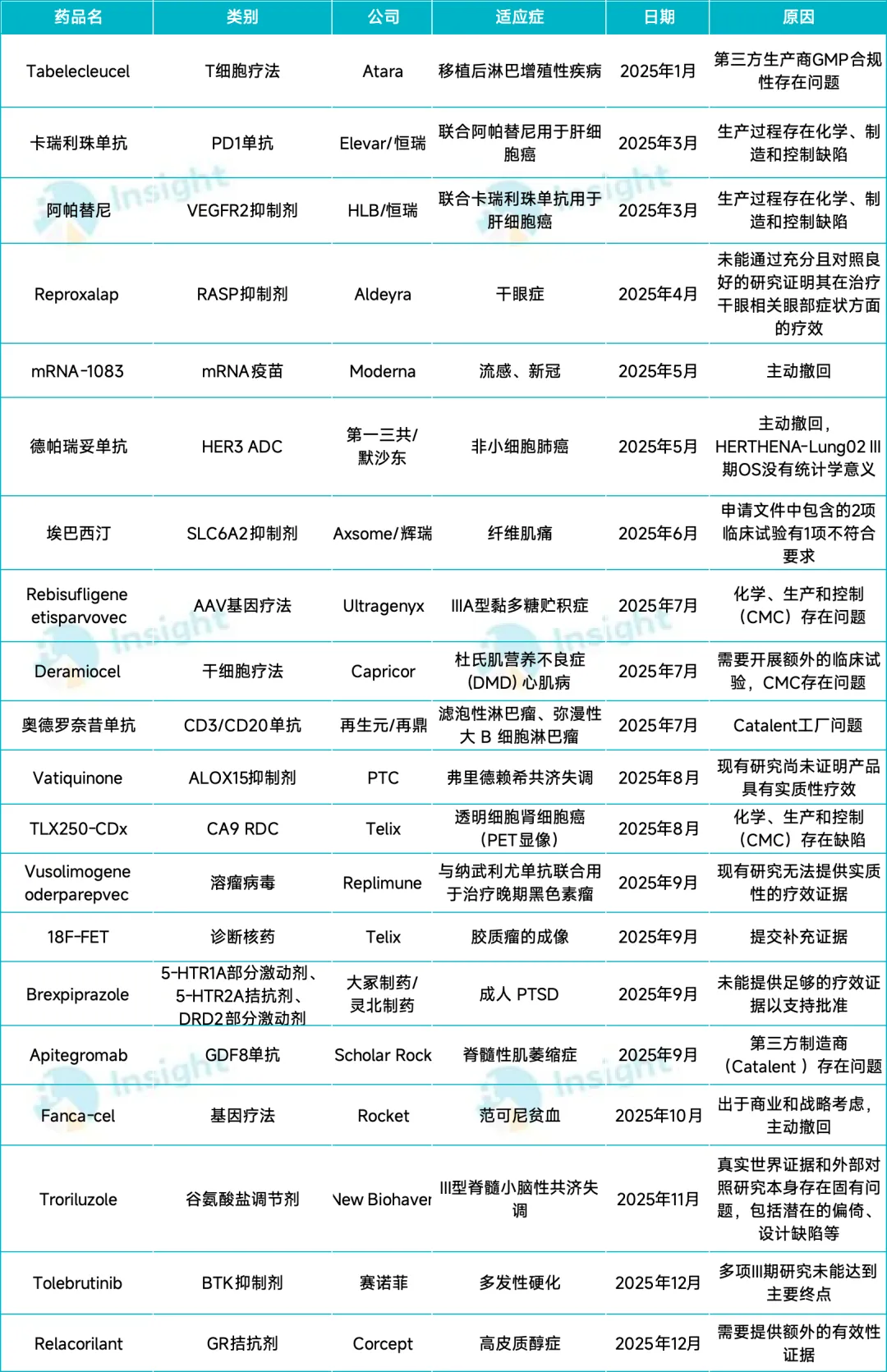
此类监管受挫,在近两年非常普遍。据不完全统计,2025 年至少有 20 款新药折戟 FDA,其中不乏 Biotech 的核心管线。监管受阻后,相关企业不仅市值腰斩,有些甚至直接开启了裁员、削减研发成本等自救行动。
2025 年 FDA 拒批的新药
新药上市受挫背后
一款新药能够进入 NDA 阶段,往往意味着它已经走过了早期开发、临床前研究和临床试验的漫长征程。但从监管角度来看,真正的生死大考,才刚刚开始。不少被行业寄予厚望的明星产品,正是止步于此。
据统计,近两年 FDA 拒绝批准新药上市的原因,主要集中在三个方面:疗效数据不足、安全性存疑,以及 CMC(化学、生产和控制)过程具有缺陷。这三大拦路虎也是创新药上市进程被卡的普遍症结所在。
赛诺菲的 BTK 抑制剂 Tolebrutinib 便是因疗效和安全性被拒的典型例子。这款产品是赛诺菲花费 37 亿美元收购 Principia Biopharma 获得的,被开发用于多发性硬化症。2025 年 3 月,赛诺菲向 FDA 递交了 Tolebrutinib 首个上市申请,适应症为非复发进展型多发性硬化症(nrSPMS)。
然而短短 9 个月后,FDA 发出 CRL 明确拒绝批准 Tolebrutinib 上市,原因包括:存在严重的药物性肝损伤风险、获益人群模糊不清,缺乏足够的证据证明其对减缓残疾程度累积的影响(与复发活动无关),以及患者亚群没有显示出获益大于风险。
另外,生产缺陷正逐渐成为新药上市的最大杀手,近些年因 CMC 问题被 FDA 拒绝的新药越来越多。
比如第三方生产制造商 Catalent 被 FDA 列为 OAI(官方行动指示,发现重大违规)状态,直接导致 Scholar Rock 的脊髓性肌萎缩症候选新药 Apitegromab、再生元的淋巴瘤双抗新药 Odronextamab 和眼科新药 Eylea HD 未能如期获批。为此,再生元引入了新的第三方,Scholar Rock 计划更换商业化生产伙伴。
国内恒瑞医药的免疫联合疗法(卡瑞利珠单抗+阿帕替尼)也曾因生产合规性、数据一致性问题,两次被 FDA 拒批。
不过从监管逻辑来看,相较于疗效与安全性这类「硬伤」,CMC 与生产缺陷反而属于更易修复的 「短板」。前者往往需要补充大量临床数据,耗时长久且结果存在不确定性,后者整改路径清晰明确,尽管需要投入较高的时间与资金成本,但最终效果具有较强的可预期性。
FDA 拒批不是终点
在资本市场,FDA 的 CRL 往往被视为失败判决书,股价暴跌、市值蒸发、项目被唱衰,几乎是标准剧情。但把时间轴拉长来看,这些年上市的新药,很多都曾遭遇过监管障碍。FDA 拒批,更多时候可能只是一次倒逼药企查漏补缺的强制校准。
2022 年,辉瑞的罕见病战略意外遭遇滑铁卢,其研发的儿童生长激素缺乏症药物 Ngenla,在提交上市申请后被 FDA 亮红灯。值得注意的是,该药彼时已率先在日本、澳大利亚、加拿大等多个国家斩获上市许可,此番在美遇阻,颇令行业侧目。
FDA 在 CRL 中明确了拒批的原因:在 III 期开放标签临床研究中,一名受试者的年身高增长速度(AHV)出现了令人担忧的下降,也就是生长速度变慢了。FDA 要求辉瑞提供相关数据,证明 Ngenla 诱导产生的抗药抗体,既不会对患者长期使用 Ngenla 实现的生长获益产生影响,也不会干扰其他重组人生长激素制剂。
面对监管部门的严苛要求,辉瑞迅速推进补充研究并完善申报资料。最终,其重新提交的申请中所包含的详实数据成功打消了 FDA 的顾虑,这款曾折戟的药物也于次年顺利通过审评,敲开了美国市场的大门。
这样的例子不胜枚举,强生的埃万妥单抗皮下注射剂型、安斯泰来的佐妥昔单抗...在上市之前,都曾收到过 FDA 的 CRL。所以,FDA 的拒批从来都不是终点。真正的终点,是企业在拒批之后,是否能够坚持下去走向更高标准。
去年 9 月,FDA 宣布将实时发布未来签发给申办方的 CRL。这一动作不仅倒逼药企精进自身,同时为行业提供了可参考的监管标尺,从底层逻辑上推动医药行业的创新迭代与高质量发展。

 研发追踪
研发追踪
 药融圈
药融圈  2026-01-20
2026-01-20
 3
3

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-01-20
2026-01-20
 6
6

 研发追踪
研发追踪
 医药笔记
医药笔记  2026-01-19
2026-01-19
 168
168