 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 89
89
2026年1月27日,美国旧金山和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域创新药物的生物制药公司,宣布其抗GPRC5D/BCMA/CD3三特异性抗体IBI3003获得美国食品和药物监督管理局(FDA)授予快速通道资格(Fast Track Designation, FTD),拟定适应症为接受过含一种蛋白酶体抑制剂(Pl)、一种免疫调节药物(IMiD)及一种抗CD38单抗的至少四线治疗的复发或难治性多发性骨髓瘤(R/R MM)。(内容引自信达生物官方公众号)
IBI3003由信达生物专属Sanbody®平台构建,目前正在中国、澳大利亚和美国(即将启动)开展I/II期临床研究探索在R/R MM的有效性和安全性。
2025年美国血液学会年会(ASH)会议上口头报告IBI3003的临床数据,在既往至少经历过两线治疗失败的符合条件的R/R MM受试者中观察到的令人鼓舞的安全性和疗效信号(点击查看原文):
39例既往接受过三类药物治疗(PI、IMiD和抗CD38单抗)的R/R MM患者接受了剂量范围为0.1 μg/kg到800 μg/kg IBI3003治疗并至少接受了一次基线后肿瘤评估。截至2025年11月7日,患者中位随访时间为3.25个月(0.4-7.4),中位治疗持续时间为12.14 周(1.0-33.0)。
在接受≥120 μg/kg剂量治疗的24例患者中,ORR为83.3%,包括4例sCR、7例VGPR和9例PR;其中10例伴有髓外病变(EMD)的患者ORR达80%,9例既往接受过抗BCMA和/或抗GPRC5D治疗的患者ORR达77.8%。经中心实验室下一代测序(NGS)检测评估达到CR及以上疗效的患者(n=4)中微小残留病变(MRD)阴性率为100%。
细胞因子释放综合征(CRS)均为1-2级,仅2例发生1-2级免疫效应细胞相关神经毒性综合征(ICANS);GPRC5D靶点相关的口腔、皮肤、指甲相关TEAE大多数为1-2级,仅有2例3级皮疹。
信达准备在美国开360例的早期临床,预计今年4月1日开始,2027年12月31日完成主要结果。
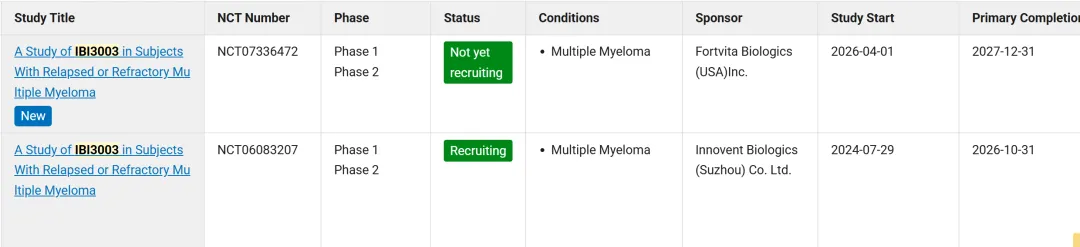
目前强生下一代三抗BCMA×GPRC5D×CD3已经启动头对头 BCMA×CD3 Global
ph3(用于既往接受过IMIDs/CD38/PI人群),PFS和ORR双主要终点设计,研究预计2026年2月20日启动,2028年12月完成主要结果,纳入400例受试者。
2025年信达ASH释放IBI3003数据,强生于2025年EHA首次释放FIH数据。强生:下一代MM三抗开展Global Ph3
强生数据显示,126例患者接受JNJ-5322治疗(36例接受100 mg Q4W),中位随访8.2个月,99%患者发生≥1起AE,最常见为CRS(59%,均为1级[45%]/2级[14%],无≥3级)、16%出现皮疹(无≥3级),2%发生ICANS(均为1级),5例患者出现剂量限制性毒性,4例因AE死亡。
在可评估患者中,RP2D剂量组(n=36)ORR达86%(75%≥VGPR),总体人群的ORR为73%(66%≥VGPR,n=124)。未接受过抗BCMA/GPRC5D治疗的患者在RP2D剂量组ORR达100%(89%≥VGPR,n=27),且所有缓解持续(中位随访8.5个月)。中位首次缓解时间为1.2个月。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 66
66

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 62
62

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 89
89